Wat is chemische periodiciteit?
- 1217
- 225
- Dewey Powlowski
De Chemische periodiciteit Het is een trend of patroon dat de chemische elementen vertoont voor een set van hun chemische en fysische eigenschappen. Het wordt een soort verwantschap, die een fundamentele gids was voor chemie ouders om alle elementen in het bekende periodieke tabel van vandaag te organiseren en te classificeren.
De 118 bestaande elementen (tussen natuurlijke en kunstmatige) behouden in andere mate een relatie met elkaar die hen definieert in families of groepen. In het begin liet dit de reactiviteiten van de elementen beschrijven, evenals het type verbindingen dat zich vormt; En nog beter, voorspellen de eigenschappen van degenen die nog niet waren ontdekt.
 De elementen van het periodiek systeem
De elementen van het periodiek systeem Toen, terwijl de twintigste eeuw en de fysica vorderden, waren deze eigenschappen gecorreleerd met de elektronische structuur van het atoom. Aldus markeren elektronen chemische periodiciteit met betrekking tot de elementen, maar niet zozeer voor hun isotopen en relatieve stabiliteit.
Dankzij chemische periodiciteit is het mogelijk om te begrijpen waarom de elementen in dezelfde groep in het periodiek systeem worden geplaatst. Het maakt ook de voorspelling van chemische eigenschappen mogelijk, en zelfs fysiek, tussen elementen van verschillende atoommassa's.
[TOC]
Patronen en groepen
 Net als de zigzagging -patronen van deze wolken, vertonen de eigenschappen van de elementen een periodieke en karakteristieke neiging. Bron: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Net als de zigzagging -patronen van deze wolken, vertonen de eigenschappen van de elementen een periodieke en karakteristieke neiging. Bron: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) Chemische periodiciteit wordt waargenomen, zoals verwacht, in periodieke eigenschappen. Deze worden gekenmerkt door de neiging van hun waarden omdat ze worden geëvalueerd gedurende een periodieke periode of groep.
Een zigzag, een zaag of een steile berg kan worden gekozen voor vergelijkingsdoeleinden: met ups en downs. Dat wil zeggen, periodieke eigenschappenbereik met minimaal en maximaal voor bepaalde elementen. En de relatieve posities van deze elementen komen briljant overeen met de locatie in hun respectieve groepen.
Dat is de reden waarom chemische periodiciteit nuttig is om het te analyseren op basis van groepen; Perioden zijn echter essentieel voor een volledige visie op de trend.
Kan u van dienst zijn: kaliumcarbonaat (K2CO3): structuur, eigenschappen, gebruik, verkrijgenHet zal worden gezien met de volgende voorbeelden van periodiciteit in de chemie, die niet alleen in de periodieke eigenschappen wint, maar ook in de anorganische verbindingen en, inclusief, organisch.
Ionisatieenergie
Ionisatie -energie, is, is een van de meest uitstekende periodieke eigenschappen. Hoe groter het atoom van een element, hoe gemakkelijker een van de laatste elektronen zal zijn om te verwijderen; dat wil zeggen die van Valencia. Daarom: atomen met kleine radio's hebben groot, terwijl atomen met grote radio's klein zijn.
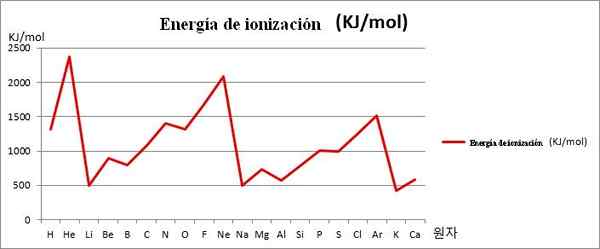 EI vs. Graphics. De eerste 20 chemische elementen. Bron: Kenneth.JH.Han/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0)
EI vs. Graphics. De eerste 20 chemische elementen. Bron: Kenneth.JH.Han/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0) Merk bijvoorbeeld op dat in de bovenstaande afbeelding de elementen Li, NA en K, de minderjarigen ei hebben, daarom bevinden ze zich in de valleien of fondsen van de afbeeldingen. Ondertussen worden de elementen die hij, NE en AR, op de toppen of hogere punten wordt gevonden, omdat ze erg groot zijn in relatie tot de andere elementen.
De elementen li, na en k behoren tot de groep alkalische metalen, gekenmerkt door hun ei -slachtoffers. Aan de andere kant komen de elementen die hij, NE en AR overeenkomen met de edelgassen, met zeer hoog, omdat hun atomen de kleinste zijn van alle elementen voor dezelfde periode van het periodiek systeem.
Aldus geeft chemische periodiciteit aan dat het een groep afneemt, maar verhoogt het touren van een periode van links naar rechts.
Blokkeer hydros P
Een voorbeeld van de chemische periodiciteit buiten de periodieke eigenschappen die we zien in de hydrors van de blokelementen P.
Groep 15 bestaat bijvoorbeeld uit elementen N, P, AS, SB en BI. Als het bekend is dat de ammoniak, NH3, Het heeft de stikstof met een oxidatienummer van +3, dan is het mogelijk te verwachten, door eenvoudige periodiciteit, dat de resterende elementen ook vergelijkbare hydros hebben. En het is inderdaad: NH3, PH3, As3, SBH3 en BIH3.
Kan u van dienst zijn: BORON: Geschiedenis, eigenschappen, structuur, gebruikEen ander soortgelijk geval treedt op met groep 16. Zuurstofhydride is h2Of water. Er wordt nogmaals verwacht dat de elementen S, SE, TE en PO hydroren hebben met gelijke formules, maar met verschrikkelijke verschillende eigenschappen. En dat is: h2S, H2Se, h2Te en h2Po. Dit komt door chemische periodiciteit.
Misschien wordt het meest indrukwekkende voorbeeld begrepen door koolstof, silicium en germanium hydros. Koolstofhydride is cho4, En dat van silicium, sih4. De Germanio, voorspeld door Mendeleev met de naam Eka-Silicio (ES), moet als periodiciteit een hydride met GEH-formule hebben4; Voorspelling die uiteindelijk werd bevestigd na de ontdekking en daaropvolgende studies.
Halogeenmoleculen
Als bekend is dat fluoride in elementaire toestand is als een M -molecuul2, Dan wordt aangenomen dat de andere halogenen (CL, BR, I en AT) ook diatomeeënmoleculen vormen. En dat is het zijn van de CL -moleculen2, BR2 en ik2 De best bekende.
Oxiden en sulfiden
Evenzo zoals vermeld met blokhydroren P, Oxiden en sulfiden voor elementen van dezelfde groep vertonen een soort correspondentie in hun respectieve chemische formules. Lithiumoxide is bijvoorbeeld li2Of zijn oxiden voor andere alkalische metalen of groep 1: NA2OKÉ2Of, RB2O en CS2OF.
Dit komt omdat in allemaal de metalen met een oxidatienummer van +1, interactie met een anion of2-. Hetzelfde gebeurt met hun sulfiden: li2S, NA2S, etc. In het geval van alkalinotherreuze metalen of groep 2 zijn de formules van hun oxiden en sulfiden respectievelijk: bijen en BES, MGO en MGS, CAO en CAS, SRO en SRS, BAO en BAS.
Het kan u van dienst zijn: Selsitair zuur (H2SO3): eigenschappen, risico's en gebruikDeze periodiciteit is ook (gedeeltelijk) van toepassing op de oxiden van de blokelementen P: CO2, SIO2, Geo2, B2OF3, Naar de2OF3, GA2OF3, enz. Voor blokelementen D of anderen van het blok P, Deze periodiciteit wordt gecompliceerder vanwege de hoogst mogelijke oxidatienummers voor hetzelfde element.
Koper en zilver zijn bijvoorbeeld tot groep 11. Eén heeft twee oxiden: Cuo (Cu2+) en Cu2Of (cu+); Terwijl de andere nauwelijks slechts één heeft: geleden (Ag+)).
Koolwaterstoffen en silanen
Zowel koolstof als silicium hebben het vermogen om respectievelijk C-C of Si-Si-bindingen te vormen. C-C-bindingen zijn veel stabieler, dus koolwaterstofstructuren kunnen onevenredig talrijker en gevarieerder worden dan die van hun siltan-tegenhangers.
Deze conclusie is opnieuw te wijten aan chemische periodiciteit. Bijvoorbeeld ethane, cho3Ch3 of c2H6 Het disilanum heeft zijn tegenhanger, sih3Ja h3 of als2H6.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Helmestine, Anne Marie, pH.D. (26 augustus 2020). Periodie definitie in chemie. Hersteld van: Thoughtco.com
- EN. V. Babaev, & Ray Hefferlin. (S.F.)). Concept van chemische periodiciteit:
Van Mendeleev Molecular Table Hyper-periaticiteitspatronen. Hersteld van: chem.MSU.Ru - Bloemen p., Theopold K., & Langley R. (S.F.)). Periodie. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De open universiteit. (2020). Chemische patronen zijn te vinden in de periode tabel: chemische periodiciteit. Hersteld van: open.Edu
- « Stabiel balansconcept en voorbeelden
- Landelijke sociologie geschiedenis, studiegeschiedenis, belang »

