Wat is de uitgifte van de emissie? (Met voorbeelden)
- 864
- 129
- Hugo Crooks
Hij emissie spectrum Het is het spectrum van golflengten van het licht dat wordt uitgezonden door de atomen en moleculen bij het maken van een overgang tussen twee energiestaten. Wit licht of zichtbaar licht dat een prisma beïnvloedt, wordt opgesplitst in verschillende kleuren met specifieke golflengten voor elke kleur. Het gekleurde patroon is het zichtbare stralingsspectrum genaamd emissiespectrum.
Atomen, moleculen en stoffen hebben ook een emissiespectrum als gevolg van lichtemissie wanneer ze de juiste hoeveelheid energie in het buitenland absorberen om tussen twee energietoestanden te reizen. Door dit licht door een prisma te geven, breekt het af in spectrale gekleurde lijnen met verschillende golflengten van elk element.
Het belang van het emissiespectrum is dat het mogelijk maakt om de samenstelling van onbekende stoffen en astronomische objecten te bepalen door de analyse van de spectrale lijnen met behulp van emissiespectroscopietechnieken.
Vervolgens wordt uitgelegd waar het emissiespectrum uit bestaat, enkele voorbeelden en de verschillen tussen het emissiespectrum en de absorptie worden genoemd.
[TOC]
Wat is een emissiespectrum?
De atomen van een element of substantie hebben elektronen en protonen die verenigd blijven dankzij de kracht van elektromagnetische aantrekkingskracht. Volgens het Bohr -model zijn elektronen zo bereid dat de energie van het atoom zo laag mogelijk is. Op dit niveau van energie -energie wordt de fundamentele staat van het atoom genoemd.
Wanneer de atomen energie uit het buitenland verwerven, gaan elektronen naar een hoger energieniveau en verandert het atoom hun fundamentele status in een opgewonden toestand.
Kan u van dienst zijn: elektromagneet: compositie, onderdelen, hoe het werkt en applicatiesIn de geëxciteerde toestand is de tijd van duurzaamheid van het elektron erg klein (≈ 10-8 s) (1), het atoom is onstabiel en keert terug naar de fundamentele toestand die indien nodig doorgaat door tussenliggende niveaus van energie.
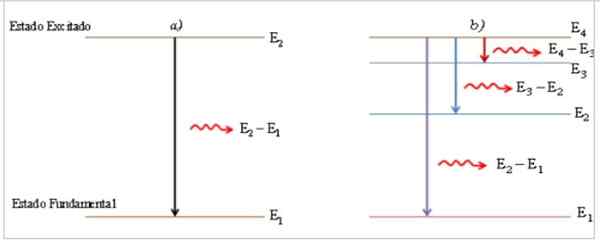
 Figuur 1. a) Emissie van een foton vanwege de overgang van het atoom tussen het niveau van excitatie -energie en het fundamentele energieniveau. b) Emissie van fotones vanwege de overgang van het atoom tussen tussenliggende energieniveaus.
Figuur 1. a) Emissie van een foton vanwege de overgang van het atoom tussen het niveau van excitatie -energie en het fundamentele energieniveau. b) Emissie van fotones vanwege de overgang van het atoom tussen tussenliggende energieniveaus. In het overgangsproces van een geëxciteerde toestand naar een fundamentele toestand zendt het atoom een foton van licht met energie gelijk aan het verschil in energie tussen de twee toestanden, direct evenredig met de frequentie V en omgekeerd evenredig met zijn golflengte λ λ.
Het uitgezonden foton wordt weergegeven als een briljante lijn, spectrale lijn (2) genoemd, en de spectrale energieverdeling van de verzameling fotonen die in de atoomovergangen zijn gegoten, is het emissiespectrum.
Interpretatie van het emissiespectrum
Sommige van de atoomovergangen worden veroorzaakt door verhoogde temperatuur of door de aanwezigheid van andere externe energiebronnen zoals een lichtstraal, een stroom van elektronen of een chemische reactie.
Als een gas zoals waterstof in een camera met lage druk wordt geplaatst en een elektrische stroom door de kamer wordt geleid, zal het gas een licht uitzenden met een eigen kleur dat het van andere gassen zal onderscheiden.
Bij het passeren van het uitgezonden licht, door een prisma, in plaats van een regenboog van licht te verkrijgen, worden discrete eenheden verkregen in de vorm van kleurlijnen met specifieke golflengten, die afzonderlijke hoeveelheden energie transporteren.
De emissiespectrumlijnen zijn uniek in elk element en het gebruik ervan uit de spectroscopietechniek maakt het mogelijk om de elementaire samenstelling van een onbekende stof te bepalen, evenals de samenstelling van astronomische objecten, door analyse van de golflengten van de fotonen die tijdens de atoomovergang zijn uitgestoten tijdens de atoomovergang.
Kan u van dienst zijn: acute geluiden: kenmerken en voorbeeldenVerschil tussen het emissiespectrum en het absorptiespectrum.
In de absorptieprocessen en emissie heeft het atoom overgangen tussen twee energietoestanden, maar het is in de absorptie die externe energie krijgt en de staat van excitatie bereikt.
De spectrale emissielijn is tegen het continue spectrum van wit licht. In de eerste wordt de spectrale verdeling waargenomen in de vorm van heldere lijnen en in de tweede wordt een continue band van kleuren waargenomen.
Als een witte lichtstraal een gas zoals waterstof beïnvloedt, vergrendeld in een lage drukkamer, wordt slechts een deel van het licht geabsorbeerd door gas en wordt de rest overgedragen.
Wanneer het overgedragen licht een prisma kruist, ontleedt het in spectrale lijnen, elk met een andere golflengte, die het gasabsorptiespectrum vormen.
Het absorptiespectrum is volledig tegen dat van emissie en is ook specifiek voor elk element. Bij het vergelijken van beide spectra van hetzelfde element wordt waargenomen dat de spectrale emissielijnen die zijn die ontbreken in het absorptiespectrum (figuur 2).
 Figuur 2. A) Emissiespectrum en b) Absorptiespectrum (auteur: STKL. Bron: https: // commons.Wikimedia.org/wiki/main_page)
Figuur 2. A) Emissiespectrum en b) Absorptiespectrum (auteur: STKL. Bron: https: // commons.Wikimedia.org/wiki/main_page) Voorbeelden van emissiespectra van chemische elementen
a) De spectrale lijnen van het waterstofatoom, in het zichtbare gebied van het spectrum, zijn een 656 rode lijn.3 nm, een lichtblauw van 486.1 nm, een donkerblauw van 434 nm en een zeer zwak violet van 410 nm. Deze golflengten worden verkregen uit de Balmer -Rydberg -vergelijking in zijn moderne versie (3).
Het is het golfnummer van de spectrale lijn
Het kan je van dienst zijn: hoor kracht: oppervlakte- en massakrachtenHet is Rydberg's Constant (109666.56 cm-1)
is het hoogste energieniveau
is het hoogste energieniveau
 figuur 3. Waterstofemissiespectrum (auteur: Adrignola. Bron: Commons.Wikimedia.borg
figuur 3. Waterstofemissiespectrum (auteur: Adrignola. Bron: Commons.Wikimedia.borg b) Het heliumemissiespectrum heeft twee reeksen hoofdlijnen, één in het zichtbare gebied en een dicht bij de ultraviolet. Peterson (4) gebruikte het Bohr -model om een reeks heliumemissielijnen te berekenen in het zichtbare spectrumgedeelte, als gevolg van verschillende gelijktijdige overgangen van twee elektronen om n = 5 toe te staan, en verkregen waarden van de golflengte bestaande uit experimenteel resultaat. De verkregen golflengten zijn 468.8nm, 450.1 nm, 426.3 nm, 418.4nm, 412.2 nm, 371.9 nm.
c) Het natriumemissiespectrum heeft twee zeer briljante 589 nm en 589 lijnen.6nm genaamd lijnen D (5). De andere lijnen zijn veel zwakker dan deze en voor praktische doeleinden wordt geacht dat al het natriumlicht uit de D -lijnen komt.
Referenties
- Meting van de levens van opgewonden toestand van het waterstofatoom. V. NAAR. Ankudinov, s. V. Bobashev en E. P. Andreev. 1, 1965, Sovjet Physics Jetp, Vol. 21, PP. 26-32.
- Demtröder, W. Laserspectroscopie 1. Kaiserslautern: Springer, 2014.
- D.K.Rai, s.N Thakur en. Atoom, laser en spectroscopie. New Delhi: Phi Learning, 2010.
- Bohr Revisited: Model en Spectral Lines of Helium. Peterson, c. 5, 2016, Journal of Young Investigators, Vol. 30, pp. 32-35.
- Journal of Chemical Education. J.R. Toepassen, f. J. Yonke, r. NAAR. Edgington en S. Jacobs. 3, 1993, vol. 70, pp. 250-251.
- « De 18 meest verslavende stoffen en hun effecten
- Voor altijd alleen wat betekent het en waarvoor wordt gebruikt »

