Proteolysetypen en functies
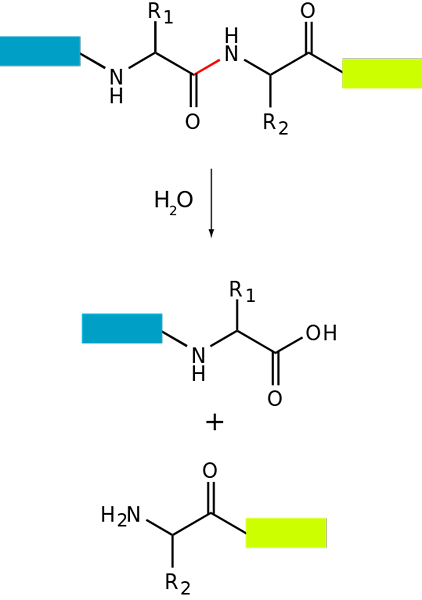
- 2956
- 662
- Aaron Okuneva
De Proteolyse o Degradatie van eiwit is een proces waarbij een cel -eiwitten volledig kunnen worden afgebroken (zelfs hun samenstellende aminozuren) of gedeeltelijk (producerende peptiden). Dat wil zeggen, het bestaat uit de hydrolyse van een of meer van de peptidebanden die hun aminozuren bij elkaar houden.
Dit proces kan optreden dankzij de deelname van andere eiwitten met enzymatische activiteit, waarvan de actieve locaties de hydrolyse van de links voordoen. Het kan ook optreden door niet -enzymatische "methoden", zoals door werking van warmte of stoffen met extreme pH (zeer zuur of zeer basic).
 Basic proteolysisschema van een eiwit (bron: fdardel [cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Basic proteolysisschema van een eiwit (bron: fdardel [cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Eiwitafbraak treedt op bij zowel bacteriën als dieren en planten, maar het is vooral gebruikelijk bij dieren, vooral op het niveau van de spijsvertering, omdat het afhangt van de spijsvertering en darmabsorptie van de eiwitten die met het dieet zijn ingenomen.
Bovendien is proteolyse van het grootste belang voor functioneel onderhoud en regulatie van meerdere cellulaire processen en heeft ook te maken met de eliminatie van eiwitten met vertaling, vouwen, verpakking, import, werking, enz.
Het is belangrijk op te merken dat het een onomkeerbaar, uiterst effectief proces is dat ook werkt in de "regulering van regulatoren", omdat het niet alleen die eiwitten elimineert die "directe" biologische activiteiten hebben, maar ook die welke andere eiwitten reguleren of de expressie van de overeenkomstige genen.
[TOC]
Soorten proteolyse
Interne eiwitten van een cel kunnen willekeurig of selectief worden afgebroken of, wat gelijk is, gecontroleerd of niet. Op zijn beurt, zoals eerder vermeld, kan dit proces plaatsvinden via speciale enzymen of vanwege omgevingscondities gedefinieerd als zure en/of alkalische pH.
Kan u van dienst zijn: epitheliale coatingweefselHet is belangrijk om te vermelden dat elk goed vertaald eiwit, gevouwen of verpakte een of meer sequenties van afbraaksignalen verbergt die "cryptisch" zijn en die kunnen worden blootgesteld wanneer het eiwit structureel wordt verstoord door temperatuur, pH, pH, enz.
Ubiquitinatie -proteolyse
Ubiquitinatie (ubiquitine-proteosoomsysteem) is een systeem waarbij eiwitten selectief kunnen worden gehydrolyseerd na specifiek gemarkeerd voor afbraak, een proces dat zowel in cytosol als in de celkern kan optreden.
Dit systeem heeft de mogelijkheid om eiwitten te herkennen en te vernietigen die zijn gemarkeerd in de kern en in het cytosol, en om eiwitten af te breken die niet correct worden gevouwen tijdens de translocatie van het cytosol naar het endoplasmatisch reticulum.
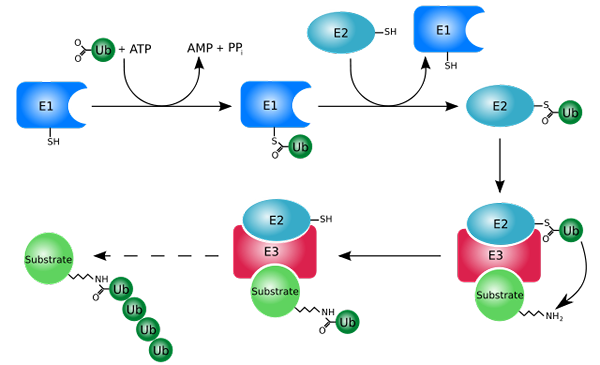 Markeringsproces met ubiquitinas (ubiquitinatie) (bron: rogerdodd [cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons)
Markeringsproces met ubiquitinas (ubiquitinatie) (bron: rogerdodd [cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons) Het werkt voornamelijk door de "witte" eiwitten toe te voegen of te vervullen aan een klein eiwit of peptide van 76 aminozuurafval, beter bekend als ubiquitine. Die "gemarkeerde" eiwitten door ubiquitinatie worden afgebroken in kleine fragmenten door het 26S -proteosoom, een protease van verschillende subeenheden.
Autofagie proteolyse
Autofagie wordt ook door sommige auteurs beschouwd als een vorm van proteolyse, met het onderscheid dat dit plaatsvindt in een gesloten membraancompartiment dat is gericht op lysosomen (in dierencellen), waarbij de erin in de eiwitten worden afgebroken door lysosomale proteasen.
Niet -enzymatische proteolyse
De temperatuur, de pH en zelfs de concentratie zouten van een medium kunnen de hydrolyse van de peptidebindingen veroorzaken die de aminozuren van verschillende soorten eiwitten bij elkaar houden, wat optreedt door destabilisatie en onderbreking van de banden.
Functie
Proteolyse heeft veel functies in levende organismen. In het bijzonder heeft het te maken met eiwitvervanging.
Kan u van dienst zijn: ribosomen: kenmerken, typen, structuur, functiesEiwitten hebben een halfwaardetijd dat varieert van enkele seconden tot enkele maanden en de producten van hun afbraak, of het nu wordt gereguleerd of niet, gemedieerd door enzymen of niet, ze worden over het algemeen hergebruikt voor de synthese van nieuwe eiwitten, die waarschijnlijk verschillende functies vervullen,.
Dit is wat er gebeurt met de eiwitten die worden geconsumeerd met voedsel, die worden afgebroken in het maagdarmkanaal door proteasen, waaronder tripsine en pepsine; evenals met sommige cel -eiwitten wanneer cellen voldoende voedsel missen om te overleven.
Intracellulaire proteolytische systemen detecteren en elimineren "abnormale" eiwitten die mogelijk toxisch zijn voor cellen, omdat ze kunnen interageren met "fysiologisch ongepaste" liganden, naast het produceren van aggregaten die mechanische en fysieke impedimenten voor normale cellulaire processen veroorzaken.
De accumulatie van abnormale eiwitten in het interieur van de cellen, hetzij als gevolg van defecten in het interne proteolytische systeem of om andere redenen, is wat veel wetenschappers beschouwen als een van de belangrijkste oorzaken van veroudering in meercellig levende wezens.
In het immuunsysteem
De gedeeltelijke proteolyse van veel eiwitten uit exogene of buitenlandse bronnen zoals binnenvallende micro -organismen, bijvoorbeeld, is een fundamenteel proces voor het immuunresponsysteem, omdat T -lymfocyten korte fragmenten herkennen, product van proteolyse (peptiden) die aan hen worden gepresenteerd in samenhang met hen in samenwerking een oppervlakte -eiwitset.
Deze peptiden kunnen afkomstig zijn van het ubiquitinatiesysteem, autofagische processen of geen gecontroleerde proteolyse -gebeurtenissen.
Andere functies
Een andere functie van beperkte of gedeeltelijke proteolyse is de modificatie van nieuw gevormde eiwitten, die functioneert als een "voorbereiding" voor zijn intra-extracellulaire functies. Dit is bijvoorbeeld waar voor bepaalde hormonen en voor de eiwitten die betrokken zijn bij verschillende metabolische processen.
Het kan u van dienst zijn: lymphaopoyese: kenmerken, fasen, reguleringDe geprogrammeerde celdood (apoptose) hangt ook grotendeels af van de "plaatsspecifieke" proteolyse, beperkt of gedeeltelijk van intracellulaire eiwitten, die wordt gemedieerd door een waterval van specifieke proteasen die caspases worden genoemd, caspases genoemd.
Extracellulaire regulatiesystemen zijn ook afhankelijk van locatiespecifieke proteolyse en het meest uitstekende voorbeeld is dat van bloedstolling.
Algemene of volledige proteolyse vervult ook primaire functies voor selectieve afbraak van die eiwitten waarvan de concentratie zorgvuldig moet worden gecontroleerd, afhankelijk van de fysiologische, metabolische of celontwikkelingstoestand.
In planten
Planten gebruiken ook proteolytische processen voor de controle van veel van hun fysiologische en ontwikkelingsaspecten. Het werkt bijvoorbeeld bij het handhaven van intracellulaire omstandigheden en in de reactiemechanismen op stressvolle omstandigheden zoals droogte, zoutgehalte, temperatuur, onder andere.
Evenals bij dieren, proteolyse in groente. In deze organismen is de proteolyse door ubiquitinatie een van de belangrijkste.
Referenties
- Alberts, B., Bray, D., Hopkin, K., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, p. (2013). Essentiële celbiologie. Slingerwetenschap.
- Maurizi, m. R. (1992). Proteaseses en eiwitafbreiding in Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, een. (2005). Gereguleerde eiwitafbraak. Trends in Biochemical Sciences, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteolyse in planten: mechanismen en functie. In post-transcriptionele controle van genexpressie in planten (PP. 275-302). Springer, Dordrecht.
- Wolf, D. H., & Messen, r. (2018). Mechanismen van celregulatie-proteolyse, de grote verrassing. FEBS Letters, 592 (15), 2515-2524.
- « Paradise Ave -kenmerken, habitat, eigenschappen, reproductie, zorg
- Trypanosoma Cruzi -kenmerken, levenscyclus, ziekten, symptomen »

