Fysische en chemische eigenschappen van water

- 1442
- 72
- Kurt Aufderhar Jr.
De Fysische en chemische eigenschappen van water Het zijn al die manifestaties van het water dat we kunnen meten dankzij de interacties van hun moleculen met zichzelf of hun omgeving. Maar wat is water? Water is een chemische stof of molecuul die wordt gevormd door de vereniging van een zuurstofatoom (O) met twee waterstofatomen (H).
Deze drie atomen blijven verenigd door de vorming van covalente bindingen, zeer sterke en stabiele links. Het watermolecuul is voor formule h2Of, kunnen schrijven als h-o-h. Het is dit molecuul, zijn links en zijn interacties zijn verantwoordelijk voor een kleurloze en smaakloze vloeibare substantie.

Water bevindt zich in een groot gedistribueerde verhouding over de aarde, tussen vers en gezouten water. Water is onmisbaar dat het leven op onze planeet bestaat, omdat het een zeer waardevolle natuurlijke hulpbron is. Het is tussen 60 en 70% in levende organismen, wat een groot deel is waarmee ze ontelbare functies kunnen vervullen.
Onder sommige van deze vitale functies zijn structurele, regulatoren zoals onderhoud van lichaamstemperatuur en pH -regulatie (zuurgraad of alkaliteit) binnen normale limieten. Evenzo voert water het transport van voedingsstoffen en afval uit in levende wezens.
Het wordt ook gebruikt in veel gebieden van het productieve, technologische, wetenschappelijke en dagelijkse routinewerk van de mens; Van toilet, onder andere eten koken.
[TOC]
Fysieke watereigenschappen
De fysische eigenschappen van water zijn gerelateerd aan de kenmerken of magnitudes die kunnen worden gemeten of bepaald bij het overwegen van materie, zoals de massa, energie, onder andere.
Onder de fysieke watergroottes zijn de kleur, de geur, de manieren waarop het kan worden gevonden, en al diegenen die we kunnen bepalen zonder reacties of de chemische samenstelling veranderen.
Smaak
Door wat zuiver water naar ons gehemelte te proeven, blijkt dat het insabor of smakless is. Het is even geurloos of geur. Voor het zuiveringsproces kan een lichte geur worden waargenomen die te wijten is aan chloorresiduen. Het zijn de mineralen die het water verschillende letters van smaken toekennen.
Aspect

Water in het algemeen is kleurloos en transparant wanneer het wordt waargenomen in een glazen glas. Het lijkt er echter op dat het een lichte lichtblauwe kleur had wanneer het in grote hoeveelheden in grote containers is verzameld, of wanneer het wordt waargenomen in gletsjers, rivieren of zeeën.
Kan u van dienst zijn: wat zijn onderzoeksbronnen?En in feite vertoont het water een zekere bleke blauwachtige kleuring, waarvan de perceptie geconcentreerd is, hoe hoger de hoeveelheid water.
Waterstaten
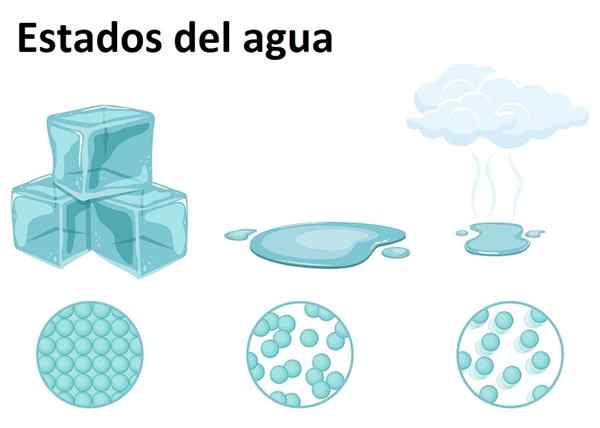 Vaste, vloeibare en gasvormige toestand
Vaste, vloeibare en gasvormige toestand Water is zeer overvloedig op aarde en kan worden gevonden in een van de drie toestanden van materie: vast, vloeistof of gasvormig. Water bij kamertemperatuur is een vloeibare substantie, die overeenkomt met de meest voorkomende vorm.
Als vaste stof wordt water ijs of sneeuw genoemd, afhankelijk van de grootte van zijn kristallen en het proces van de vorming. Ondertussen vormt de gasvormige toestand wanneer het water van de vloeibare toestand naar de gasvorming gaat, die de beroemde waterdamp vormt, gemakkelijk herkenbaar in de keuken en boven voedsel.
Dikte
Pure waterdichtheid varieert ongeveer 1 g/cm3. Ondertussen is de dichtheid van zeewater een beetje hoger vanwege het zout dat het bevat.
Vriespunt
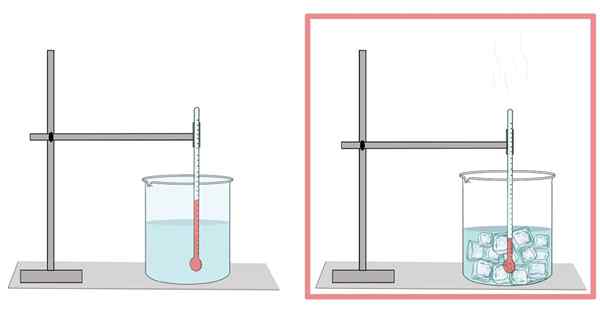
Water bevriest bij 0 ° C. Bij deze temperatuur gaat van zijn vloeibare fase naar de vaste stof. Wanneer het water wordt bevroren, breidt het zich uit. Dat is de reden waarom het in zijn vaste vorm minder dichtheid heeft dan in zijn vloeibare toestand, waardoor het voor ijs gemakkelijker kan drijven op vloeibaar water.
Evenzo is dit de reden waarom waterkoeling in een fles niet veel zou moeten worden gevuld, omdat het ijs zich uitbreidt en de fles breekt.
Kookpunt
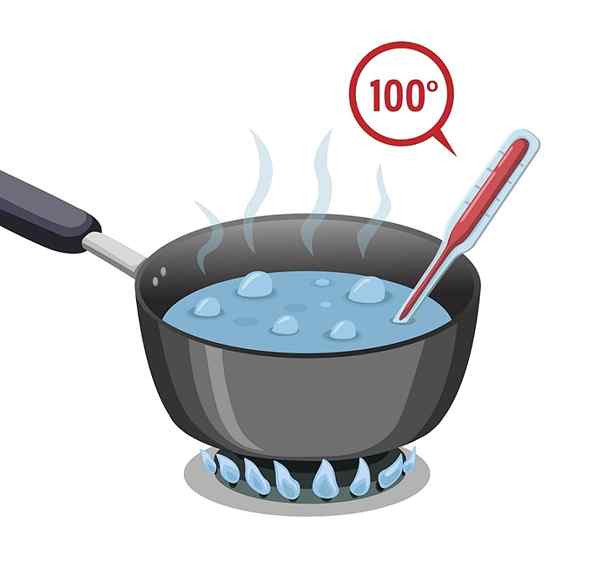
Het water heeft een hoog kookpunt dat 100 ° C is. Het moet aan heet worden onderworpen, zodat het kan verwarmen en kookt of zijn kookpunt kan bereiken.
Het water heeft dan een hoge specifieke warmte, of wordt ook warmtecapaciteit genoemd, waardoor het vertraging in de verwarming doet; Maar ook om te koelen, dat wil zeggen het proces dat nodig is om de verworven warmte te verliezen, is langzaam.
Deze eigenschap maakt het erg nuttig in koelsystemen, in lichaamstemperatuurregulatiesystemen, onder andere gerelateerd.
Elektrische geleidbaarheid
Water is een goede elektriciteitsgeleider. Hoe zuiver het water ook een zekere hoeveelheid ionen heeft, waardoor het een van de hoogste diëlektrische constanten heeft onder niet -metalen vloeistoffen.
Samenhang
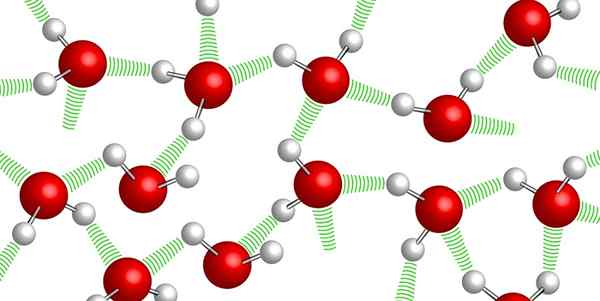 Waterstofbruggen tussen watermoleculen
Waterstofbruggen tussen watermoleculen Watermoleculen blijven samen met elkaar dankzij de zo -gekalde waterstofbruggen: zwakke bindingen die zijn vastgesteld tussen de ene watermolecuul. Vanwege dit hoge niveau van cohesie is het erg moeilijk om water te comprimeren.
Kan u van dienst zijn: 7 documentaire onderzoeksinstrumentenToetreding

Het is gemakkelijk voor water om bijvoorbeeld te hechten aan het goed schone oppervlak van een glas, waardoor een film wordt gevormd, die we vocht of "nat" noemen. Ook houdt water zich snel aan onze huid, dus we worden nat zodra we in een zwembad komen. Anders zouden we binnen enkele seconden drogen.
Oppervlaktespanning
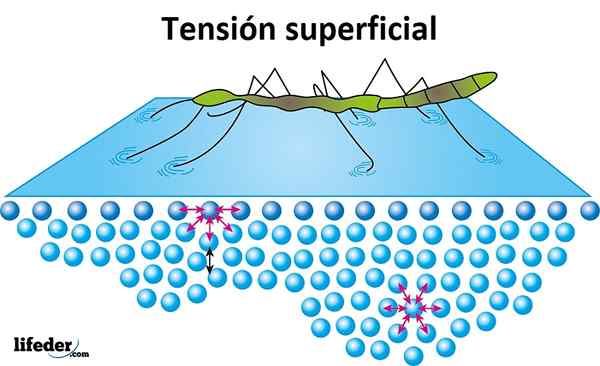
De oppervlaktespanning is de weerstand die door de vloeistof op het oppervlak wordt aangeboden om door te dringen. Water heeft een hoge oppervlaktespanning, product van de cohesie die bestaat tussen zijn moleculen, waardoor het gemakkelijk wordt gevormd, in plaats van vrijelijk een glad oppervlak te verspreiden.
De oppervlaktespanning wordt bewezen wanneer insecten lijken te bewegen of op het water te lopen zonder te zinken, en het is de reden waarom sommige bladeren of andere lichte objecten over het water kunnen drijven.
Capillariteit

Het gemak waarmee het water opkomt of laag door een capillaire buis beschrijft, beschrijft de eigenschap van het water van het water. Deze eigenschap is ook te wijten aan de hoge eigenschappen van cohesie en hechting die water heeft.
De capillariteit wordt door de plantaardige aard benut om water te leveren aan de bladeren van de hoogste takken van een boom, en vergemakkelijkt de absorptie door de wortels van de planten.
Evenzo maken de eigenschappen van oppervlaktespanning en capillariteit het water een structureel deel van de cellen, dat deel uitmaakt van het bloed, en dat loopt of stroomt gemakkelijk door de verschillende bloedvaten.
Oplosmiddelactie

Water kan veel stoffen oplossen, wat van vitaal belang is voor levende organismen, omdat alle chemische reacties van levende wezens voorkomen in een waterige omgeving. In levende organismen dient het als een transport van voedingsstoffen, ionen en vele andere stoffen.
Het dient ook voor het transport van afval, zoals ureum, dat wordt geëlimineerd in urinewater. Wanneer een stof oplost en goed mengt met water, wordt gezegd dat deze hydrofiel of hydrosolule is. Als u niet goed mengt of oplost, wordt gezegd dat de stof hydrofoob of onoplosbaar is in water.
Chemische watereigenschappen
Chemische eigenschappen of kenmerken zijn die die optreden wanneer veranderingen in de chemische structuur van water worden geproduceerd. Het is dan belangrijk om een korte blik op de moleculaire structuur te bekijken.
Chemische aard
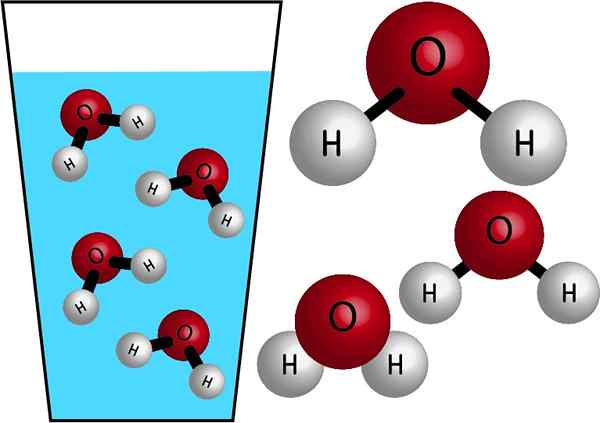
Water is een anorganisch molecuul, omdat het geen C (koolstof) bevat, en zijn chemische formule is h2OF. Hun atomen worden verbonden door elektronen te delen die covalente bindingen vormen, sterke en zeer stabiele links. De molaire massa is 18 g/mol, dat wil zeggen, één mol water heeft een massa van 18 gram.
Kan u van dienst zijn: wetenschappelijk onderzoekPolariteit
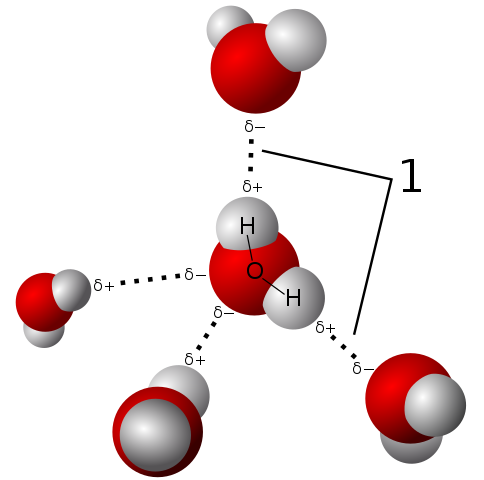 Waterpolariteit stelt zijn molecuul in staat om zeer sterke waterstofbruggen vast te stellen
Waterpolariteit stelt zijn molecuul in staat om zeer sterke waterstofbruggen vast te stellen Het watermolecuul is neutraal, maar het presenteert een bepaalde polariteit, omdat het delen van zijn elektronen niet zo rechtvaardig is.
Omdat zuurstof de gedeelde elektronen voor zichzelf sterker aantrekken, is het watermolecuul aan deze kant waar zuurstof de neiging heeft om een negatieve belasting te hebben; En daarom blijft het met een positieve gedeeltelijke belasting waar de hydrogenen zijn (observeer het superieure beeld).
Deze polariteit vergemakkelijkt de vereniging met elkaar van de watermoleculen en de waterunie met andere moleculen die ook belastingen hebben in hun structuur, die de in de vorige paragraaf beschreven fysische eigenschappen bevorderen.
Ionisatie
Spontaan in vloeibaar water is er een lichte ionisatie of zelfdissociatie. Het betekent dat sommige van zijn moleculen worden gereorganiseerd door de normale moleculaire structuur te veranderen die nieuwe elektrisch geladen moleculen genereren, zoals hydroniumionen (h3OF+) en hydroxyl (oh-)).
Reactieve capaciteit
Water reageert met veel stoffen en vormt een grote diversiteit aan chemische verbindingen. Door elektrolyse kan water worden verbroken door zuurstof te scheiden van zijn twee hydrogenen. Dit proces treedt op wanneer een elektrische stroom door water gaat. Zelfs water in zijn vaste vorm kan ook deel uitmaken van sommige chemische reacties.
pH
 pH bijna 7
pH bijna 7 Zuiver water heeft een neutrale pH (gelijk aan 7), terwijl zeewater enigszins alkalisch is (groter dan 7). Regenwater wordt enigszins aangezuurd (pH minder dan 7) wanneer gemengd met de componenten die in de atmosfeer worden gevonden, zoals koolstofdioxide of CO2, Bijvoorbeeld.
Anfoterisme
Water is amfotaat, dat wil zeggen dat het zich als een zuur of als een basis kan gedragen, afhankelijk van de pH van de oplossing. Deze chemische eigenschap ondersteunt zijn rol als PH -regulator.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Castillero M. OF. (2020). Psychologie en geest. De 15 fysische en chemische eigenschappen van water. Hersteld van: psychologie en.com
- Wikipedia (2020). Eigenschappen van water. Opgehaald uit: in.Wikipedia.borg
- Scherpe K. NAAR. (S.F.)). Water: structuur en eigenschappen. Hersteld van: kristal.Med.Omhoogn.Edu
- Byju's. (S.F.)). Fysische en chemische eigenschappen van water. Hersteld van: byjus.com
- School Energy & Milieu. (S.F.)). Water was een bron. Hersteld van: Eariscuola.netto
- « Glycocálix functioneert dat het ontmoet en componenten
- Contabalgation -concept, typen, kenmerken »

