Adiabatische procestypen, voorbeelden, oefeningen opgelost
- 2447
- 754
- Glen Armstrong
A Adiabatisch proces Het is degene waar er geen warmte -uitwisseling is tussen het systeem en zijn omgeving, hetzij omdat het plaatsvindt binnen een isolatiemedium, of omdat het zeer snel voorbijgaat. Dit betekent dat dit in de omgeving van het systeem het deel van het onderzochte universum is, temperatuurveranderingen niet moeten worden waargenomen, maar alleen werk.
Dit is een van de elementaire processen van de thermodynamica. In tegenstelling tot de andere processen (isocorisch, isobarisch en isotherme), blijft geen van zijn fysieke variabelen constant; dat wil zeggen, de magnitudes van druk, volume, temperatuur en entropie veranderen naarmate het adiabatische proces evolueert.
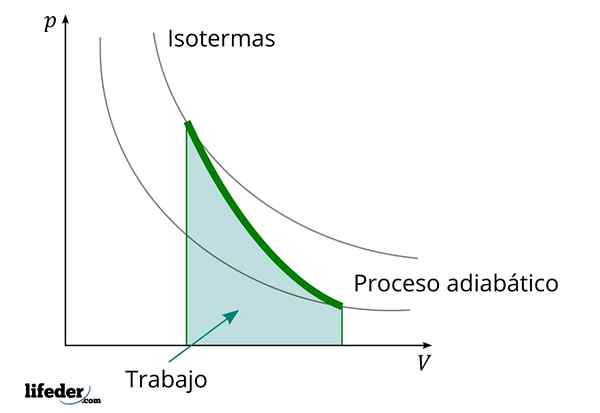
 Tijdens een adiabatisch proces waarin het volume toeneemt, is de interne energie van de stof die het werk afneemt
Tijdens een adiabatisch proces waarin het volume toeneemt, is de interne energie van de stof die het werk afneemt Een ander belangrijk kenmerk van de adiabatische processen is dat ze werkzaam werken of consumeren evenredig met de variatie van de interne energie van hun systemen; In dit geval van die van zijn moleculen in een gasfase. Dit kan worden aangetoond dankzij de eerste wet van de thermodynamica.
In het dagelijks leven omvat dit type proces vooral op geofysische fenomenen en, tot op zekere hoogte, het functioneren van zuigers in de dieselmotoren. Warmteoverdracht wordt vaak voorkomen met het gebruik van een isolatiemedium, maar het is de snelheid van deze processen die hun echte ontwikkeling mogelijk maken.
[TOC]
Omkeerbare en onomkeerbare adiabatische processen
Omkeerbaar
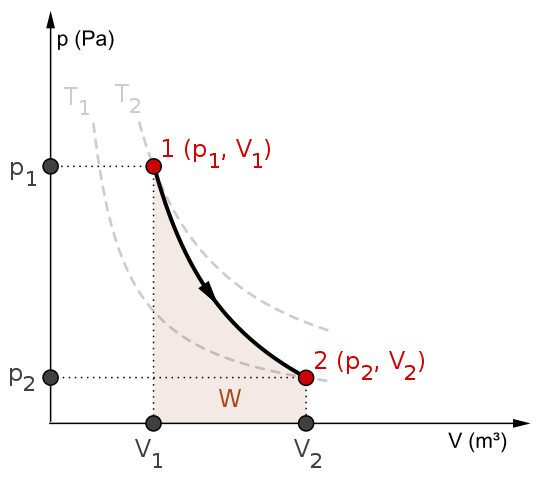 P-V-diagram en werk W voor een adiabatisch proces. Bron: mikerun/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0)
P-V-diagram en werk W voor een adiabatisch proces. Bron: mikerun/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0) Adiabatische processen kunnen omkeerbaar of onomkeerbaar zijn. De eerste bestaan echter alleen als theoretische hulpmiddelen om dit laatste te bestuderen. De omkeerbare adiabatische processen omvatten dus de ideale gassen, en missen wrijving en elke andere mogelijkheid die een warmteoverdracht tussen het systeem en zijn omgeving veroorzaakt.
Overweeg bijvoorbeeld het P-V-diagram voor het omkeerbare adiabatische proces van bovenaf. T1 en t2 komen overeen met twee isothermen, waarop de druk P en de volumes V van het systeem variëren.
Onder de staten (p1, V1) En P2, V2) Een omkeerbare adiabatische expansie wordt uitgevoerd, omdat we van een volume V gaan1 tot één V2, groter, na de richting van de pijl.
Daarbij koelt het systeem, maar zonder het gedrag van isothermen te gehoorzamen. Het gebied onder de curve komt overeen met werk W, waarvan de waarde positief is omdat het een uitbreiding is.
In dit proces blijft de entropie constant en daarom wordt gezegd dat deze isontropisch is. De wiskundige verwerking van deze omkeerbaarheid genereert een reeks vergelijkingen waarmee het mogelijk is om andere systemen te evalueren.
Kan u van dienst zijn: elektrolytische cellenOnomkeerbaar
Onomkeerbare adiabatische processen zijn, in tegenstelling tot de omkeerbare, niet grafisch in de P-V-diagrammen met continue maar gestippelde lijnen, omdat alleen de uiteindelijke en initiële toestanden hun variabelen hebben (P, V en T) goed gedefinieerd. Deze processen omvatten echte gassen, dus de vergelijking van ideale gassen en hun afleidingen zijn niet direct op hen toepasbaar.
Ze passeren snel, waardoor warmteoverdracht tussen het systeem en zijn omgeving voorkomen. Ook neemt de entropie toe, zoals vermeld in de tweede wet van de thermodynamica.
Voorbeelden van adiabatische processen
 De isolerende capaciteit, zoals die gepresenteerd door Thermos, is een van de belangrijkste factoren voor een proces om adiabatisch te ontwikkelen
De isolerende capaciteit, zoals die gepresenteerd door Thermos, is een van de belangrijkste factoren voor een proces om adiabatisch te ontwikkelen Enkele voorbeelden van adiabatische processen worden hieronder vermeld.
Uitbreiding en begrip
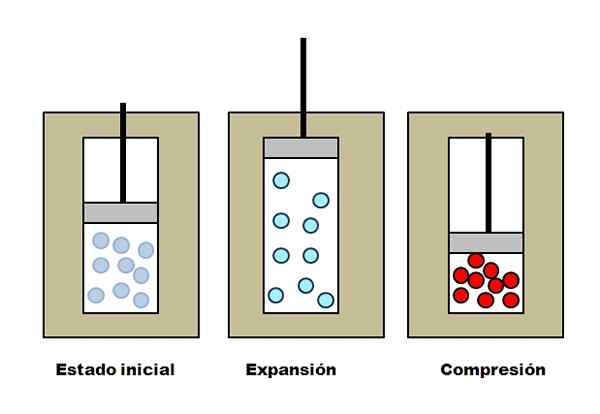 Adiabatische uitbreiding en begrip. Bron: Gabriel Bolívar.
Adiabatische uitbreiding en begrip. Bron: Gabriel Bolívar. Stel dat drie isolerende vesten die compartimenten bevatten vol met gas. In een initiële toestand heeft de zuiger geen druk op gas. Vervolgens mag de zuiger stijgen, wat het volume verhoogt waardoor de gasmoleculen kunnen bewegen, wat een afname van zijn interne energie veroorzaakt; En daarom een afname van de temperatuur.
Het tegenovergestelde gebeurt met adiabatische compressie: de zuiger voert werk aan gas uit, waardoor het volume wordt verminderd dat zijn moleculen kunnen bezetten. Interne energie neemt deze keer toe, wat ook een toename van de temperatuur inhoudt, waarvan het warmte niet kan worden verspreid naar de omgeving vanwege het isolerende vest.
Magma Ascent
De kanalen waar magma stijgt in een vulkaan vertellen als een isolerend medium, dat warmteoverdracht tussen magma en atmosfeer voorkomt.
Geluidspreiding
De gassen worden gestoord en uitgebreid volgens de geluidsgolf zonder te koelen of heet de lucht om hen heen.
Foehn Effect
Het Foehn -effect is een voorbeeld van adiabatische processen op het gebied van geofysica. De luchtmassa's stijgen naar het bovenste deel van een berg waar ze minder druk ervaren, zodat hun moleculen uitzetten en afkoelen, waardoor de vorming van de wolk aanleiding geeft.
Ze dalen echter nauwelijks af aan de andere kant van de berg, de druk neemt toe en daarom worden de moleculen gecomprimeerd en verhogen ze hun temperatuur, waardoor de wolk verdwijnt.
Kan u van dienst zijn: chloorbenzeen (c6h5cl)In de volgende video kan dit fenomeen worden op prijs gesteld:
Opgeloste oefeningen
Ten slotte zullen een paar oefeningen worden opgelost. Het is belangrijk om de volgende vergelijkingen bij de hand te hebben:
Δu = q - w (eerste wet van thermodynamica)
Maar met geen warmteoverdracht, q = 0 y:
Δu = - w (1)
Dit is: als werk W positief is, is Δu negatief en vice versa. Aan de andere kant hebben we ook:
W = -NCVΔt (2)
Dat na het toepassen van de ideale gasevergelijking (PV = NRt), en vervangen en oploegen voor t2 en t1 we zullen hebben:
W = (cV/R) (P1V1 - P2V2) (3)
De waarde van r gelijk aan 0 zijn.082 L · ATM/MOL · K of 8.314 J/Mol · K
In adiabatische processen is het belangrijk om de C -relatie te kennenP/CV bekend als γ:
γ = cP/CV (4)
Waardoor T-V- en P-V-relaties mogelijk zijn:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
En ook de geschatte hitte van CP en CV Ze variëren afhankelijk van of de gassen monoatomisch, diatomic, etc. zijn.
Oefening 1
Een gas presteert 600 J werk via een geïsoleerd compartiment. Wat is de verandering in zijn interne energie? Neemt de temperatuur af of verhoogt? En gezien het feit dat het een monoatomisch gas is, bereken ook γ.
Gegevens:
W = +600J
Δu = ¿?
γ =?
W Work is positief omdat gas werkt op de omgeving. In een geïsoleerd compartiment zijn, q = 0, en daarom zullen we vergelijking hebben (1):
Δu = - w
Dat wil zeggen, Δu is gelijk aan:
Δu = - (+600J)
= -600J
Wat betekent dat de interne gasergie met 600 J afnam. Als Δu afneemt, neemt dat ook de temperatuur, zodat het gas koelt als gevolg van het werk.
Omdat dit gas monoatomisch is,
CV = 3/2 r
CP = 5/2 r
En zijn
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 of 1.66
Oefening 2
In een container 7 mol O o2 Ze werden gecomprimeerd van een volume van 15 liter tot 9 liter. Wetende dat de initiële temperatuur 300 K was, bereken: het werk dat op gas is gedaan.
Gegevens:
N = 7 mol of2
T1 = 300 K
V1 = 15 l
V2 = 9 l
W = ¿?
Het is een onomkeerbaar adiabatisch begrip. We hebben twee vergelijkingen om W:
W = -NCVΔt (2)
W = (cV/R) (P1V1 - P2V2) (3)
De druk kan ze berekenen, maar om tijd te besparen is het beter om door te gaan met de eerste van de vergelijkingen:
Kan u van dienst zijn: gedistilleerd waterW = -NCVAT
= -NCV (T2-T1))
We hebben C nodigV en t2 Om W te bepalen. Zuurstof, een diatomee gas, heeft een cV gelijk aan 5/2 r:
CV (OF2) = 5/2 r
= 5/2 (8.314 J/mol · k)
= 20.785 J/Mol · K
We moeten t berekenen2. We gaan naar vergelijking (5):
T1V1γ-1 = T2V2γ-1
Maar voordat u het gebruikt, moet u eerst bepalen CP en γ:
CP (OF2) = 7/2 r
= 7/2 (8.314 J/mol · k)
= 29.099 J/Mol · K
Γ zijn gelijk aan:
γ = cP/CV
= (29.099 j / mol · k) / 20.785 J/Mol · K
= 1.4
Dus we kunnen dit wissen2 Uit vergelijking (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1))
= [(300k) (15l)1.4-1] / (9L)1.4-1
= 368.01 K
En eindelijk lossen we op voor w:
W = -NCVAT
= -(7 mol O2) (Twintig.785 J/mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 kJ
Oefening 3
Een neoncontainer breidt adiabatisch uit en aanvankelijk bij kamertemperatuur (t = 298k) van 12 l tot 14 l. Wetende dat de initiële druk 3 atm was, wat zal het werk zijn dat het gas heeft gedaan?
Gegevens:
T1 = 298 K
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Vergelijking (3) stelt ons in staat om W te bepalen met de waarden van de druk:
W = (cV/R) (P1V1 - P2V2))
Maar we missen CV En P2.
De uiteindelijke druk kan worden berekend met vergelijking (6):
P1V1γ = P2V2γ
Γ zijn gelijk aan CP/CV. Omdat neon een monoatomisch gas is, hebben we zijn C -waardenP en CV Ze zijn respectievelijk 5/2R en 3/2R. We berekenen dan γ:
γ = cP/CV
= (5/2r)/(3/2r)
= 5/3 of 1.66
We wissen p2 Uit vergelijking (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
En werk zal gelijk zijn aan:
W = (cV/R) (P1V1 - P2V2))
= (3/2) [(3 atm) (12 l) - (1.40 ATM) (14 L)] (101300 PA/1 ATM) (0.001 m3/L) (kj/1000 j)
= 2.49 kJ
Conversiefactoren worden gebruikt om de l · atm een pa · m om te zetten3, die gelijkwaardig is aan 1 j. Neongas groeit uit, dus de druk neemt af en bij het werken aan de omgeving is dit positief. Ook neemt de interne energie Δu af, evenals de temperatuur, koeling in het expansieproces.
Referenties
- Walter J. Moore. (1963). Fysische chemie. In chemische kinetiek. Vierde editie, Longmans.
- Iran. Levine. (2009). Principes van fysicochemie. Zesde editie. MC Graw Hill.
- Wikipedia. (2020). Adiabatisch proces. Opgehaald uit: in.Wikipedia.borg
- Jones, Andrew Zimmerman. (18 augustus 2020). Themodynamica: adiabatisch proces. Hersteld van: Thoughtco.com
- Devoe Howard & Neils Tom. (9 augustus 2020). Adiabatische veranderingen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Wat is het mechanische equivalent van warmte?
- Maderismo geschiedenis, ideologie, vertegenwoordigers, gevolgen »

