Le châtelier principe

- 1239
- 115
- Alton D'Amore
Wat is het principe van Le Châtelier?
Hij Le châtelier principe Het is een algemene regel die het effect voorspelt dat de verschillende factoren die de chemische balans beïnvloeden hebben. In het bijzonder helpt het om te voorspellen in welke richting een reactie die in evenwicht is, zal bewegen wanneer een dergelijk evenwicht wordt verstoord door een externe agent.
Dit principe bepaalt dat:
"Wanneer een systeem dat in evenwicht is, onderhevig is aan een verstoring of een externe spanning, reageert het systeem in de richting waarmee het dergelijke verstoring gedeeltelijk kan tegengaan".
Verstoring wordt goed begrepen:
- Een verandering in de concentratie van een van de reagentia.
- Een verandering in de concentratie van een van de producten.
- Veranderingen in druk.
- Veranderingen in volume.
- Een verandering in temperatuur
Wanneer er veranderingen optreden zoals de vermelding, heeft een van de twee reacties, de directe of het omgekeerde, de voorkeur ten opzichte van de andere, zodat het systeem in die zin reageert op een nieuwe staat van evenwicht.
Dit is vergelijkbaar met de aanpassingen van een balancer op de koord. Wanneer Gravity Hala aan de ene kant, reageert de balancer door naar de andere kant te gaan. We zeggen dat zijn evenwicht is bewogen, omdat hij nog steeds in balans is (hij valt niet), maar nu heeft hij een andere positie.
Vervolgens zullen we zien hoe het le châtelier -principe wordt gebruikt om de richting te voorspellen waarin een systeem zal reageren door verschillende soorten spanningen of storingen te lijden, zoals: veranderingen in concentratie, volume, druk en temperatuur.
Effect van veranderingen in concentratie
Stel dat we de volgende reactie in balans hebben:
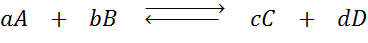
Als we de concentratie van een van de betrokken soorten veranderen (A, B, C of D), voorspelt het principe van Le Châtelier dat het systeem zal reageren om deze wijziging tegen te gaan, hetzij de overtollige toegevoegde of herstel van de geëlimineerde hoeveelheid. 4 verschillende situaties kunnen worden gegeven:
1. Verhoogde concentratie van reagentia
Als we de concentratie van een reagens bijvoorbeeld verhogen tot, volgens het principe van Le Châtelier, zal het systeem reageren om het toegevoegde overtollige te consumeren. Dit betekent dat het direct zal reageren (van links naar rechts), omdat deze richting wordt verbruikt.
In dit geval wordt gezegd dat de directe reactie wordt begunstigd en dat het evenwicht naar de producten is verplaatst, omdat in de nieuwe balans de concentratie van producten groter is dan die in het oorspronkelijke evenwicht.
Kan u van dienst zijn: magnetische scheiding2. Verhoogde concentratie van producten
Als we de concentratie van een product verhogen, bijvoorbeeld C, zal het systeem omgekeerd reageren om de toegevoegde overtollige C te consumeren (dat wil zeggen van rechts naar links).
In dit geval wordt gezegd dat de omgekeerde reactie de voorkeur heeft en dat de balans naar de reagentia beweegt.
3. Afname van de reagensconcentratie
De afname van de concentratie heeft het tegenovergestelde effect op de toename van genoemde concentratie. Als we zich uit het medium terugtrekken, waardoor de concentratie wordt verminderd, reageert het systeem naar links (omgekeerd) om de verandering tegen te gaan. De balans beweegt naar de reagentia.
4. Afname van de concentratie van producten
Als we de concentratie van C of D verminderen, reageert het systeem rechtstreeks om de verminderde concentratie te vervangen (dat wil zeggen van links naar rechts). De balans gaat naar de producten.
Voorbeeld:
Bepaal het effect van het toevoegen van meer tiocianaationen (SCN-) In de volgende chemische balans is wetende dat het product van het recht intens rood en ijzer (III) is geel.
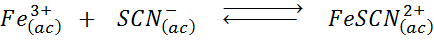
Oplossing: In dit geval voegen we Tiocianato toe dat een reagens is, dus de balans moet naar rechts gaan, waardoor de concentratie van het complex wordt verhoogd en daarom de intensiteit van de rode kleur in de oplossing.
Effect van veranderingen in volume en druk
Veranderingen in volume en druk hebben geen significante invloed op de reacties in evenwicht in vloeibare of vaste toestand, maar ze kunnen die in een gasvormige toestand beïnvloeden. Dit komt omdat, voor gassen, de concentratie evenredig is met de druk, zoals voorspeld door de ideale gassenwet.
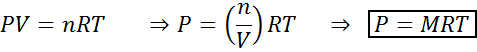
Het verhogen van de druk van een gas dat de constante temperatuur behoudt, is gelijk om het volume te verlagen, dus het effect van beide storingen zal hetzelfde zijn.
Als een totale druk toeneemt tot een evenwichtsreactie in evenwichtsreactie (of we verminderen het volume), zal het systeem reageren om een dergelijke druk opnieuw te verlagen, zodat de balans zich zal verplaatsen naar waar er een kleinere hoeveelheid gasvormige deeltjes moleculen is.
Kan je van dienst zijn: fijne laagchromatografie: kenmerken, waar is het voor In de reactie tussen stikstof en waterstof om ammoniak te vormen, worden 4 frisdrankmoleculen geconsumeerd en worden er slechts twee geproduceerd, dus een toename van de druk verplaatst de balans naar de meeste ammoniakvorming
In de reactie tussen stikstof en waterstof om ammoniak te vormen, worden 4 frisdrankmoleculen geconsumeerd en worden er slechts twee geproduceerd, dus een toename van de druk verplaatst de balans naar de meeste ammoniakvorming Als ze in de reactie worden geconsumeerd en hetzelfde aantal gasmoleculen wordt geproduceerd, hebben volume- en drukveranderingen geen invloed op de balans.
Aan de andere kant, als we alleen de gedeeltelijke druk van een van de gassen wijzigen, is het effect hetzelfde als om de concentratie van genoemde soorten te verhogen of te verminderen.
Voorbeeld:
Gezien de ontledingsreactie van dyitrogene tetroxide in evenwicht:
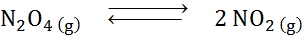
Bepaal het effect van het verminderen van het volume, toenemende druk.
Oplossing: Als we de totale systeemdruk verhogen of het volume verlagen, beweegt het evenwicht naar de reagentia, omdat er in die richting een netto afname van gasmoleculen (2 en 1) wordt verbruikt 1) waardoor de toename van de druk kan worden tegengewerkt.
Effect van temperatuurveranderingen
Het effect van de temperatuur op de chemische balans is verschillend van de andere factoren die we tot nu toe hebben gezien. In de vorige gevallen wordt een nieuw evenwicht verkregen na de verstoring, maar dezelfde evenwichtsconstante wordt gehandhaafd. Als de temperatuur echter verandert, zal de evenwichtsconstante veranderen.
Om te weten hoe de evenwichtsconstante verandert met de temperatuur, moet het teken van de reactie -enthalpie bekend zijn:
- Als een reactie warmte vrijgeeft, dat wil zeggen, deze is exotherme, is de enthalpie negatief en neemt de evenwichtsconstante af naarmate de temperatuur toeneemt. In deze gevallen beweegt het evenwicht in de tegenovergestelde richting naar de reagentia.
- Als een reactie warmte absorbeert, dat wil zeggen, het is endotherm, de enthalpie is positief en het tegenovergestelde gebeurt.
Het onthouden van het effect van temperatuur is eenvoudig als we warmte beschouwen als een reagens dat optreedt in het geval van exotherme reacties en wordt geconsumeerd in het geval van endotherm. Het verhogen van de temperatuur zou zijn als "toevoegen" warmte aan het systeem en het koelen zou gelijkwaardig zijn om het te verwijderen.
Dus als een reactie exotherme is en de temperatuur wordt verhoogd, zou het zijn als het toevoegen van een product van de reactie, dus de balans beweegt in de tegenovergestelde richting, naar de reagentia, en als deze het tegenovergestelde afkoelt.
Het kan u van dienst zijn: Píchric Acid: wat is, structuur, synthese, eigenschappenAan de andere kant, als een reactie endotherm is en de temperatuur wordt verhoogd, zou het zijn als het toevoegen van een reagens, dus de balans beweegt naar de producten, terwijl een afname van de temperatuur het tegenovergestelde effect heeft.
Voorbeeld:
De ontledingsreactie van n2OF4 Het heeft een +58,0 kJ/mol reactie enthalpie. In welke richting de balans zal bewegen als de temperatuur wordt verlaagd?
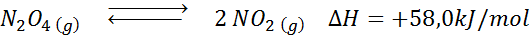
Oplossing: Omdat enthalpie positief is, is de reactie endotherm. Om deze reden zal het koelen de omgekeerde reactie bevorderen, en de balans zal naar de reagentia gaan, dat wil zeggen naar de vorming van meer n2OF4.
Effect van katalysatoren, remmers en inerte stoffen
Katalysatoren en remmers beïnvloeden de snelheid waarmee reacties optreden, maar ze beïnvloeden zowel directe als indirecte reactie. Om deze reden hebben ze geen invloed op de evenwichtstoestand.
Aan de andere kant heeft de toevoeging van een inerte stof als een gas dat niet reageert met een van de reagentia of producten, geen invloed.
Toepassing van het principe van Le Châtelier
Inzicht in dit principe is erg nuttig, omdat het ons in staat stelt de staat van evenwicht te manipuleren van een reactie op ons gemak.
In die gevallen waarin we geïnteresseerd zijn.
Dit betekent:
- Voeg grote hoeveelheden reagentia toe, als deze economisch zijn.
- Het product terugtrekken naarmate de reactie vordert, om het systeem in een constante staat van spanning te handhaven, altijd proberen om evenwicht te bereiken die rechtstreeks reageert.
- Verhoog de temperatuur in het geval van endotherme reacties.
- Verhoog de druk op die reacties waarbij meer gasemoleculen worden geconsumeerd dan ze optreden.
Misschien willen we ook de hoeveelheid product minimaliseren die wordt gevormd door een ongewenste reactie. In deze gevallen doen we het tegenovergestelde.
Toepassingsvoorbeeld van het le châtelier -principe
In de organische synthese wordt het principe van Le Châtelier constant gebruikt om de reactiesopbrengsten te verbeteren.
Bij bijvoorbeeld alcoholuitdratingsreacties worden ongeëvenaard toegevoegd aan de omgeving die het water absorbeert dat tijdens de reactie is gevormd. Dit vermindert de concentratie van dit product, dat de balans naar de producten verplaatst.

