Pyruvaatkinasestructuur, functie, regulatie, remming
- 4371
- 544
- Kurt Aufderhar Jr.
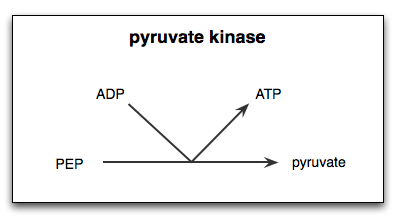
 Reactie gekatalyseerd door het enzym pyruvato kinase
Reactie gekatalyseerd door het enzym pyruvato kinase Wat is het kinasepyruvaat?
De Pyruvaatkinase ((Pyk) Het is het enzym dat de laatste stap van de glycolytische route katalyseert, die de onomkeerbare overdracht van de fosfaatgroep van een fosfoenolpiruvaat (PEP) molecuul inhoudt naar een ADP -molecuul, wat resulteert in de synthese van een ATP -molecuul en een ander pyruvinezuur of pyruvaat.
Het aldus geproduceerde pyruvaat wordt later geproduceerd, neemt deel aan verschillende katabole en anabole (biosynthetische) routes: het kan worden gedecarboxyleerd om acetyl-CoA te produceren, carboxyleerd om oxalacetaat te produceren, getransamineerd om alanine te produceren, geoxideerd om melkzuur te produceren of kan worden gericht op gluconeogene voor synthese van synthese van synthese van de synthese van synthese van synthese van synthese van synthese van synthese. glucose.
Omdat het deelneemt aan glycolyse, is dit enzym van het grootste belang voor koolhydraatmetabolisme van veel organismen, eencellig en meercellig, die dit gebruiken als de belangrijkste katabole route om energie te verkrijgen.
Een voorbeeld van strikt afhankelijke cellen van glycolyse om energie te verkrijgen, is dat van zoogdier erytrocyten, waarvoor een tekort aan een van de enzymen die aan deze route deelnemen aanzienlijk negatieve effecten kan hebben.
Pyruvaatkinasestructuur
Bij zoogdieren zijn vier isovormen van het enzympyruvaatkinase beschreven:
- PKM1, Typisch in spieren
- PKM2, Alleen in foetussen (beide producten van de alternatieve verwerking van hetzelfde messenger RNA)
- PKL, aanwezig in de lever en
- PKR, aanwezig in erytrocyten (beide gecodeerd door hetzelfde gen, PKLR, maar getranscribeerd door verschillende promotors).
De analyse van de structuur van de verschillende enzymen pyruvaatkinase in de natuur (inclusief deze 4 van de zoogdieren) vertoont echter een grote gelijkenis in de algemene structuur, evenals met betrekking tot de architectuur van de actieve site en de regulerende mechanismen.
Kan u van dienst zijn: koloniale associaties: kenmerken, typen en voorbeeldenOver het algemeen is het een enzym van 200 kDa molecuulgewicht, gekenmerkt door een tetramere structuur samengesteld uit 4 identieke eiwiteenheden, min of meer 50 of 60 kDa en elk met 4 domeinen, namelijk:
- Een domein spiraalvormig Klein aan het N-terminale uiteinde (afwezig in bacterie-enzymen)
- Een domein "NAAR”, Geïdentificeerd door een topologie van 8 gevouwen β -plakjes en 8 zalen α
- Een domein "B”, Ingevoegd tussen de gevouwen bèta -lamina nummer 3 en het Alpha -domein" A "domeindomein
- Een domein "C”, Die een α+β -topologie heeft
 Moleculaire structuur van het enzympyruvaatkinase
Moleculaire structuur van het enzympyruvaatkinase Drie locaties zijn gedetecteerd in de tetrameren van het kinasepyruvaat van verschillende organismen: de actieve plaats, de effectorplaats en de aminozuurbindingsplaats. De actieve plaats van deze enzymen bevindt zich tussen domeinen A en B, nabij de "effector -site", die tot domein C behoort.
In de Tetrámero vormen D -domeinen een "kleine" interface, terwijl domeinen in een grotere interface vormen.
Functie van kinasepyruvaat
Zoals reeds vermeld, katalyseert het kinasepyruvaat de laatste stap van de glycolytische route, dat wil zeggen de overdracht van een fosfaatgroep van fosfoenolpiruvaat (PEP) naar een ADP -molecuul om een ATP en een pyruvaat- of pyruvinezuurmolecuul te produceren.
De producten van de reactie die door dit enzym wordt gekatalyseerd, zijn van het grootste belang voor verschillende metabole contexten. Pyruvaat kan op verschillende manieren worden gebruikt:
- Onder aerobe omstandigheden, dat wil zeggen, in aanwezigheid van zuurstof, kan dit worden gebruikt als een substraat van een enzym dat bekend staat als het gratis dehydrogenase pyruvaat, om te worden gedecarboxyleerd en omgezet in acetyl-CoA, een molecuul dat de Krebs-cyclus in mitochondria kan binnenkomen in mitochondria of deelnemen aan andere anabole routes zoals bijvoorbeeld vetzuurbiosynthese.
- Bij afwezigheid van zuurstof of anaerobiose kan pyruvaat worden gebruikt door het enzymlactaatdehydrogenase om melkzuur (oxidatie) te produceren door een proces dat bekend staat als "lactische gisting".
- Bovendien kan pyruvaat worden omgezet in glucose door gluconeogenese, in alanine door transaminase alanine, in oxalacetaat door carboxylase pyruvaat, enz.
Het is belangrijk om te onthouden dat in de reactie gekatalyseerde door dit enzym de netto synthese van ATP optreedt die wordt geteld voor glycolyse, die wordt geproduceerd door elk glucosemolecuul 2 pyruvaatmoleculen en 2 ATP.
Vanuit dit perspectief speelt het enzymkinase -pyruvaat dus een fundamentele rol in vele aspecten van cellulair metabolisme, zozeer, dat wordt gebruikt als therapeutisch doelwit voor veel pathogenen van de mens, waaronder verschillende protozoa opvallen.
Regulatie
Het kinasepyruvaat is een uiterst belangrijk enzym vanuit het oogpunt van celmetabolisme, omdat het degene is die de laatste verbinding vormt als gevolg van de katabolisme -route van glucose: pyruvaat: pyruvaat.
Naast een van de drie meest gereguleerde enzymen van de gehele glycolytische route (de andere twee hexoquinase (HK) en fosfofrucerachinase (PFK)), is het kinase -pyruvaat een zeer belangrijk enzym voor de controle van de metabole stroom en productie van ATP door ATP door glycolyse.
Het wordt geactiveerd door fosfoenolpiruvaat, een van zijn substraten (homotrope regulatie), evenals door andere mono- en gediposforyleerde suikers, hoewel de regulatie ervan afhangt van het type isoenzyme dat wordt overwogen dat wordt overwogen dat wordt overwogen.
Sommige wetenschappelijke teksten suggereren dat de regulering van dit enzym ook afhangt van de architectuur "multidominium", omdat de activering ervan lijkt afhankelijk te zijn van sommige rotaties in de domeinen van de subeenheden en wijzigingen in de geometrie van de actieve site.
Voor veel organismen hangt de Árosterische activering van het kinasepyruvaat af van het fructose 1,6-bifosfaat (F16BP), maar dit is niet waar voor groente-enzymen. Andere enzymen worden ook geactiveerd door cyclische AMP en glucose 6-fosfaat.
Kan u van dienst zijn: handen: kenmerken, structuur, functiesBovendien is aangetoond dat de activiteit van de meeste onderzochte pyruvaatkinasen sterk afhankelijk is van de aanwezigheid van monovalente ionen zoals kalium (k+) en divalente ionen zoals magnesium (mg+2) en mangaan (Mn+2).
Remming
Het kinasepyruvaat wordt voornamelijk geremd door fysiologische effector, dus deze processen variëren aanzienlijk tussen verschillende soorten en zelfs tussen soorten cellen en weefsels van hetzelfde organisme.
Bij veel zoogdieren hebben glucagon, epinefrine en AMPC remmende effecten op de kinasepyruvaatactiviteit, effecten die kunnen worden tegengegaan door insuline.
Bovendien is bewezen dat sommige aminozuren zoals fenylalanine acties kunnen hebben zoals competitieve remmers voor dit enzym in de hersenen.

