Gelijkwaardig gewicht
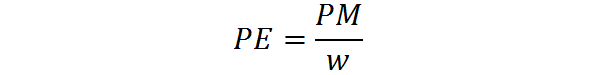
- 757
- 102
- Lonnie Rohan
Wat is het equivalente gewicht?
Hij gelijkwaardig gewicht Het is het gewicht of de massa van een equivalent van inhoud. Dat wil zeggen, het is het gewicht of de massa van een stof die chemisch gelijk is aan 1 mol van een andere stof van hetzelfde type dat wordt gebruikt als een referentiepatroon en als normaal wordt beschouwd.
De normale stof die als referentie wordt genomen, hangt af van het type chemische reactie en de rol die de verbinding in die reactie speelt. Normale verbindingen reageren altijd met elkaar met stoichiometrie 1: 1.
Als we het bijvoorbeeld over een zuur-/basisreactie hebben, zou het equivalent gewicht van een zuur het gewicht zijn van genoemde verbinding die equivalent is aan 1 mol van een normaal zuur, dat is een dat een enkel ioniseerbaar proton heeft.
Voordat het bekend was dat materie werd gevormd door atomen en moleculen, was al een reeks wetten die de massatrelatie (of gewicht) tussen de reagentia en producten van een chemische reactie hebben vastgesteld, al vastgesteld.
Deze wetten vormden de basis van stoichiometrische berekeningen tijdens het begin van de chemie als wetenschap.
Het equivalente gewichtsconcept is gerelateerd aan dit vroege stadium van de ontwikkeling van chemie. Vervolgens zullen we bespreken hoe het wordt berekend, waarvoor het is en enkele veel voorkomende voorbeelden van uw berekening.
Formule en equivalente gewichtseenheden
Het equivalente gewicht wordt berekend uit het molecuulgewicht van één stof door middel van de volgende formule:
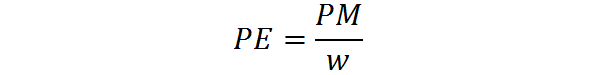
Waar PE het equivalent gewicht is, is PM het molecuulgewicht of de molaire massa van de stof, en W vertegenwoordigt het aantal equivalenten per mol.
De laatste bestaat altijd uit een gehele getal gelijk of groter dan 1. Het vertegenwoordigt het aantal moleculen van een "normaal" reagens waaraan elk stofmolecuul equivalent is. Daarom hangt het af van het type reagens in kwestie en het type chemische reactie betrokken.
Kan u van dienst zijn: dihydroxyaceton: structuur, eigenschappen, verkrijgen, gebruikHet kan ook worden berekend uit het deeg, M en het aantal equivalent:
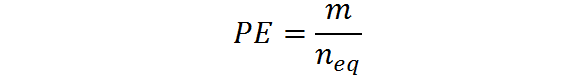
Gelijkwaardige gewichtseenheden
Zoals te zien is in de vorige formule, wordt het equivalente gewicht uitgedrukt in massa -eenheden (meestal gram) op het aantal equivalent. Dat wil zeggen, de eenheden zijn g/eq.
De waarde van W In de eerste vorige formule wordt het uitgedrukt in equivalente eenheden op mol (EQ/Mol), terwijl de molmassa tot expressie wordt gebracht in gram over mol (g/mol).
Waar is het equivalent gewicht voor?
Het belangrijkste nut van het equivalente gewicht is dat het de stoichiometrische berekeningen vereenvoudigt. Het equivalente gewicht van een stof is gelijk aan een andere stof van hetzelfde type en voor dezelfde soort chemische reactie. Van daaruit verkrijgt hij in feite zijn naam.
Hierdoor kunnen we stoichiometrische berekeningen op een zeer eenvoudige manier uitvoeren en zonder de noodzaak om chemische vergelijkingen te schrijven en in evenwicht te brengen.
Hoe wordt het equivalente gewicht berekend?
Zoals we eerder zagen, wordt het equivalente gewicht berekend uit het molecuulgewicht en het aantal equivalenten per mol of w.
Molecuulgewichtberekening
Het molecuulgewicht van een stof wordt bepaald door het atoomgewicht toe te voegen van alle atomen die het goedmaken. Deze atomaire gewichten zijn te vinden in het periodiek systeem.
Bepaling van W
De waarde van W Voor een stof hangt het af van het type reactie waarbij het erbij betrokken is. Dat wil zeggen, het hangt af van het type reagens in kwestie. Voor elk type substantie is er een andere manier om te bepalen W.
De volgende tabel laat zien hoe deze wordt bepaald W Voor verschillende gevallen.
Het kan u van dienst zijn: calciumhypochloriet (Ca (Clo) 2)| Type reagens | Waarde van W |
| Zuren | Aantal ioniseerbare hydrogenen voor elk zuurmolecuul. |
| Honken | Aantal protonen dat elk basismolecuul kan vangen of neutraliseren. |
| Oxiderende middelen | Aantal elektronen dat elk mol oxidatiemiddel vastlegt in de semi -retail van reductie. |
| Reducerende middelen | Aantal elektronen die elke mol van reductiemiddel vrijgeven in oxidatie semi -terugslag. |
| Je gaat uit | Totaal aantal positieve of negatieve ladingen die worden gegenereerd wanneer een van de zout. |
| Neutrale stoffen | 1 |
Opgemerkt moet worden dat, als een stof kan deelnemen aan meer dan één type chemische reactie, deze mogelijk meer dan één waarde heeft W En daarom meer dan één equivalent gewicht.
Belang en toepassingen van het equivalente gewicht
Het equivalente gewicht wordt gebruikt om het aantal equivalenten van een chemische stof te berekenen. Dit aantal equivalenten is altijd gelijk aan het aantal equivalenten van een andere stof waarmee het reageert.
Dit wordt voornamelijk gebruikt in twee verschillende gebieden:
In analytische chemie
De equivalenten worden vaak gebruikt om stoichiometrische berekeningen in analytische chemie te vergemakkelijken. Dit geldt met name in het geval van volumetrische en gravimetrische analyse.
De kennis van het volume van de graad op het punt van gelijkwaardigheid en de concentratie van de titulaire, evenals het equivalente gewicht van de rechten, laten de massa gemakkelijk toe om de massa van de analyt in een monster te berekenen.
In elektrolyse
In het gebied van elektrolyse vertegenwoordigt het equivalentgewicht het gewicht van één metaal of andere stof die kan optreden wanneer 96.500 ° C laden door elektrolytische cel. Dit vergemakkelijkt stoichiometrische en economische berekeningen van het elektrolyseproces.
Kan u van dienst zijn: kwikoxide (hg2o)Voorbeelden van de equivalente gewichtsberekening
Calcium
Het atoomgewicht van calcium is 40 en dit metaal vormt kationen met Valencia +2, dus het equivalente gewicht is 40/2 = 20 g/eq.
Zwavelzuur (h2SW4))
Het molecuulgewicht van deze verbinding is 98 en is een diprotisch zuur, dus W = 2. Daarom is het equivalente gewicht PE: 98/2 = 49 g/eq.
Aluminiumhydroxide (AL (OH)3))
Aluminiumhydroxide (PM = 78) is een amfoterverbinding die kan werken als zuur en als basis.
Als u als basis fungeert door uw drie hydroxiden uit te brengen, dan W = 3, So PE: 78/3 = 26 g/eq. Aan de andere kant, wanneer het als een zuur werkt, vangt het een watermolecuul en geeft het een proton vrij, dus in dit geval, W = 1 en PE = 78 g/eq.
Calciumfosfaat (CA3(PO4))2))
Calciumfosfaat is een zout dat, bij het dissociëren, 3 ca ionen produceert2+ en 2 ionen po43-.
In elk geval is het aantal belastingen van hetzelfde teken dat elke calciumfosfaateenheid produceert 6, dus W = 6 en PE = 310/6 = 51,67 g/eq.
Referenties
- Universele encyclopedie (s. F.)). Gelijkwaardig gewicht. Genomen van Encyclopedia_Universal.Es-academisch.com.
- Chemie, anorganische chemie (s. F.)). Gelijkwaardig gewicht. Genomen van fullquimica.com.
- Scheikunde.Het is s. F.)). Equivalent. Uitgevoerd uit chemie.is.
- Spiegato (2021). Wat is het equivalente gewicht? Uit Spiegato genomen.com.

