Pencanona chemische structuur, eigenschappen, synthese, gebruik
- 1275
- 6
- Nathan Wiegand
De Pentanona Het is een organische verbinding, behorend tot de familie van de ketonen, wiens chemische formule C is5H10OF. Het blijft een van de eenvoudigste ketonen en bestaat uit een kleurloze vloeistof met een aroma vergelijkbaar met die van aceton. Vanaf nu, met betrekking tot het koolstofnummer van hun skelet, presenteren de ketonen positie isomeer.
Als het gaat over positie, verwijst Issomeria naar waar de carbonylgroep is, c = o. Puntanona bestaat dus eigenlijk uit twee verbindingen met fysieke eigenschappen die nauwelijks van elkaar verschillen: 2-penon en 3-penon (lager beeld). Beide zijn vloeibaar, maar hun kookpunten zijn hetzelfde, dus ze kunnen niet worden gescheiden door destillatie.
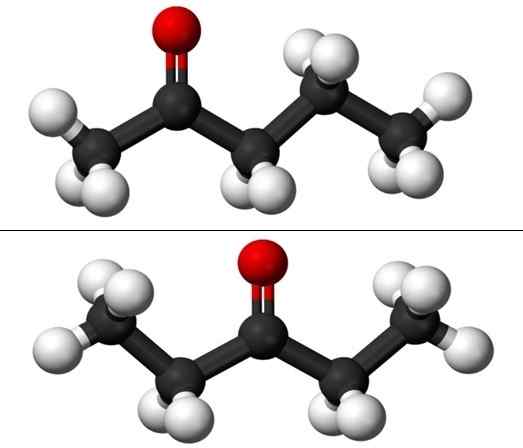
 Moleculen van de positie -isomeren voor Pentanona. Bron: Jynto & Ben Mills via Wikipedia.
Moleculen van de positie -isomeren voor Pentanona. Bron: Jynto & Ben Mills via Wikipedia. Elk van de twee pentanones heeft echter zijn eigen syntheseroute, dus het is onwaarschijnlijk dat er een mengsel van is; mengsel dat mogelijk mogelijk is om te scheiden door te bevriezen.
Het gebruik ervan is beperkt, vooral als organische oplosmiddelen; Alternatieven voor aceton in media waar u werkt met een temperatuur hoger dan het lage kookpunt. Ze zijn ook uitgangsmaterialen voor andere organische synthese, omdat hun groep C = O nucleofiele toevoeging kan verminderen of ondergaan.
[TOC]
Chemische structuur
Positie -isomeren
In het beeld hebben we de moleculaire structuren van de twee positie -isomeren voor de Puntanona, vertegenwoordigd door een model van bollen en bars. De zwarte bollen komen overeen met koolzuurhoudende skeletten, wit tot waterstofatomen en rode zuurstofatomen in groep C = O.
2-pintanon
De 2-ponanona (hierboven) heeft groep C = of in de tweede koolstof, wat gelijk is aan als het in de kamer zou zijn; dat wil zeggen, het 2-ponanona en het 4-pantanona zijn equivalent, omdat het voldoende is om ze 180º te roteren zodat hun structuren hetzelfde zijn.
Kan u van dienst zijn: koolstoftetrachloride (CCL4)Links van C = O heb je een methylradicaal, cho3-, En aan zijn rechterkant, een radicale propil. Daarom ontvangt deze Cetona ook de naam (minder gebruikt) van Metil Propil Cetona (MPK in het Engels). U kunt op het eerste gezicht de asymmetrie van deze structuur zien.
3-penon
De 3-Péntanona (hieronder) heeft groep C = O in de derde koolstof. Merk op dat deze isomeer een grotere versie van aceton is en dat het ook erg symmetrisch is; De twee radicalen aan de zijkanten van groep C = o zijn hetzelfde: twee ethylradicalen, ch3Ch2-. Dat is de reden waarom het 3-Pananona ook Cetona Diestil (of dimethylaceton) wordt genoemd.
Intermoleculaire interacties
De aanwezigheid van de carbonylgroep, zowel in de 2-pantanon als in de 3-Penona, verleent polariteit aan het molecuul.
Daarom kunnen beide pentanona-isomeren via dipool-dipol met elkaar communiceren.
Evenzo komen Londen dispersiekrachten tussen koolstof en gehydrogeneerde skeletten in mindere mate in.
Door het Puntanona, een groter moleculair gebied en massa te hebben in vergelijking met die van de aceton, draagt deze bijdrage bij aan het dipoolmoment en zorgt voor een hoger kookpunt (102 ºC> 56 ºC) om een hoger kookpunt te bezitten). In feite verdampen de twee isomeren bij 102 ºC; Terwijl ze bij verschillende temperaturen bevriezen.
Kristallen
Waarschijnlijk spelen de symmetrieën in kristallisatie een belangrijke rol. Het fusiepunt van het 2 -pantanona is bijvoorbeeld -78 ºC, terwijl de 3 -Péntanona, -39 ºC.
Kan u van dienst zijn: Avogadro LawDit betekent dat 3-pantanona kristallen stabieler zijn tegen temperatuur; De moleculen zijn meer samenhangend en vereisen meer warmte om te scheiden in de vloeibare fase.
Als er een mengsel van beide isomeren was, zou de 3-penone de eerste zijn die kristalliseert, waardoor uiteindelijk de 2-Pananona bij een lagere temperatuur is. De moleculen van het 3-pantanon, meer symmetrisch, zijn gemakkelijker georiënteerd dan die van 2-ponanona: asymmetrisch en tegelijkertijd dynamischer.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistoffen met een aroma vergelijkbaar met dat van aceton.
Molaire massa
86.13 g/mol
Dikte
0,81 g/ml (3-ponanona)
0,809 g/ml (2-ponanona)
Smeltpunt
-78 ºC (2-ponanona)
-39 ºC (3-Ponanona)
Kookpunt
102 ºC (voor beide isomeren)
Oplosbaarheid in water
35 g/l (3-Ponenona)
60 g/l (2-Ponenona)
Dampdruk
35 mmHg (3-Ponenona)
270 mmHg (2-pantanon) bij 20 ºC
Deze waarden zijn niet nuttig om de dampdruk van beide isomeren direct te vergelijken, omdat de eerste wordt gerapporteerd zonder de temperatuur waarop deze werd gemeten.
Flitspunt
12.78 ºC (3-Ponanona)
10 ºC (2-ponanona)
Stabiliteit
De twee isomeren van Pentanona zijn extreem ontvlambaar, dus ze moeten zo ver weg van elke warmtebron blijven. Flashpunten geven aan dat een vlam de dampen van beide pentana's kan instellen, zelfs bij een temperatuur van 10 ºC.
Synthese
Hoewel de twee isomeren van pentanona fysiek en chemisch zeer vergelijkbaar zijn, zijn hun synthetische routes onafhankelijk van de andere, dus het is onwaarschijnlijk dat beide worden verkregen in dezelfde synthese.
2-pintanon
Beginnend met het 2-penolreagens, een secundaire alcohol, kan dit worden geoxideerd tot 2-ponanon met behulp van hypochloreus zuur gevormd in situ, HCLO, als een oxidatiemiddel. Oxidatie zou zijn:
Het kan u van dienst zijn: geen elektrolyten: kenmerken en voorbeelden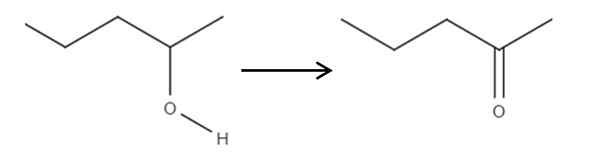 Oxidatie van 2-pantanol bij 2-pantanona. Bron: Gabriel Bolívar.
Oxidatie van 2-pantanol bij 2-pantanona. Bron: Gabriel Bolívar. Gewoon de C-OH-link wordt C = O. Er zijn andere methoden om de 2-Penona te synthetiseren, maar dit is het eenvoudigst om te begrijpen.
3-penon
De 3-pintanon kan worden gesynthetiseerd door middelen3Ch2COOH. Deze synthetische route produceert symmetrische ketonen en is dat een CHO -molecuul3COOH verliest de COOH -groep in de vorm van CO2, Terwijl de andere je groep oh in de vorm van h2OF:
2CH3Ch2COOH => ch3Ch2Bedekken2Ch3 + CO2 + H2OF
Een andere iets complexere route is om direct een mengsel van ethyleen, cho te reageren2= Ch2, CO2 en h2 Om de 3-ponanona te vormen.
Toepassingen
Tenzij de toepassing erg rigoureus is, is het een specifieke synthese, of dat ook is aangetoond dat de twee isomeren niet dezelfde resultaten veroorzaken, is het niet relevant om te kiezen tussen het gebruik van de 2-penon of 3-penon in een van zijn toepassingen.
Dat wil zeggen, "het maakt niet uit" als u de 2-ponanona of 3-Penona wilt gebruiken als een oplosmiddel van schilderijen of harsen, of als een ellendig, omdat de belangrijkste criteria de prijs en beschikbaarheid zullen worden. De 3-penon wordt in de auto-industrie gebruikt om het gedrag van gassen in interne verbrandingsmotoren te bestuderen.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Wikipedia. (2019). 3-pijn. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). 2-Pontenone. PubChem -database. CID = 7895. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Royal Society of Chemistry. (2019). 3-pijn. Hersteld van: Chemspider.com
- Hoogleraar T. Nalli. (2013). Oxidatie van 2-pintanol en destillatie van het product. Hersteld van: cursus1.Winona.Edu

