OxidorReductases -kenmerken, structuur, functies, voorbeelden
- 3794
- 5
- Dr. Rickey Hudson
De oxidorreductasen Ze zijn eiwit met enzymatische activiteit die de leiding hebben voor het katalyseren van reacties van roestreductie, dat wil zeggen reacties die de verwijdering van waterstof- of elektronenatomen in de substraten waarop ze werken impliceren waarop ze werken.
De reacties gekatalyseerd door deze enzymen, zoals de naam al aangeeft, zijn oxide-reductiereacties, dat wil zeggen reacties waarbij een molecule elektronen of waterstofatomen doneert en een ander hen ontvangt, hun respectieve oxidatietoestanden verandert.
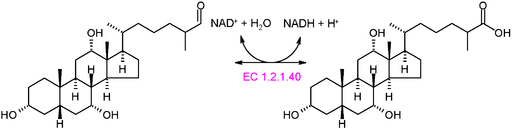 Grafisch schema van de reactie van een oxidortase van type EC 1.2.1.40 (Bron: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Grafisch schema van de reactie van een oxidortase van type EC 1.2.1.40 (Bron: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Voorbeeld van veel voorkomende oxidortische enzymen in de natuur is die van dehydrogenasen en oxidasen. Het kan worden vermeld aan het enzym van alcoholdehydrogenase, dat de dehydrogenering van ethanol katalyseert om acetaldehyde te produceren in een NAD+ -afhankelijke of de omgekeerde reactie, om ethanol te produceren tijdens de alcoholische gisting die door sommige commercieel belangrijke gisten wordt uitgevoerd,.
De enzymen van de elektronentransportieketen in de aerobe cellen zijn oxidorta's op lading van het pompen van protonen, dus genereren ze de elektrochemische gradiënt door het interne mitochondriale membraan waarmee de synthese van ATP het mogelijk maakt.
[TOC]
Algemene karakteristieken
Oxidoreductase -enzymen zijn enzymen die de oxidatie van een verbinding en de gelijktijdige reductie van een andere katalyseren.
Deze vereisen normaal gesproken de aanwezigheid van verschillende soorten co -enzymen voor hun werking. Co -enzymen vervullen de functie van doneren of accepteren.
Deze co -enzymen kunnen de NAD+/NADH Torus of het FAD/FADH2 -koppel zijn. In veel aerobe metabolische systemen worden deze elektronen en waterstofatomen uiteindelijk overgebracht van de betrokken co -enzymen naar zuurstof.
Het zijn enzymen met een uitgesproken "gebrek" van substraatspecificiteit, waardoor ze kruisrisingsreacties in verschillende soorten polymeren kunnen katalyseren, of het nu eiwitten of koolhydraten is.
Classificatie
Vaak is de nomenclatuur en classificatie van deze enzymen gebaseerd op zowel het hoofdsubstraat dat ze gebruiken als het type co -enzym dat ze nodig hebben om te functioneren.
Volgens de aanbevelingen van het Nomenclature Committee van de International Union for Biochemistry and Molecular Biology (NC-IBMB) behoren deze enzymen tot klasse E.C. 1 en neem meer of minder 23 verschillende typen op (e.C.1.1-E.C.1.23), die zijn:
Kan u dienen: erytropoëtine (EPO): kenmerken, productie, functies- EN.C. 1.1: Welke handelen in de Ch-OH-groepen donoren.
- EN.C. 1.2: Welke handelen in de Aldehyde Group of de Oxo de Los Donor Group.
- EN.C. 1.3: Welke handelen in de CH-CH-groepen donoren.
- EN.C. 1.4: Welke handelen in de Ch-NH2-groepen donoren.
- EN.C. 1.5: Welke handelen in de Ch-NH-groepen donoren.
- EN.C. 1.6: Welke handelen in NADH of NADPH.
- EN.C. 1.7: Die werken op andere stikstofverbindingen zoals donoren.
- EN.C. 1.8: Welke handelen op de zwavelgroepen donoren.
- EN.C. 1.9: Welke handelen in de Hemo -groepen donoren.
- EN.C. 1.10: Welke handelen in donoren zoals difenolen en andere gerelateerde stoffen.
- EN.C. 1.11: Welke fungeren op peroxide als een acceptor.
- EN.C. 1.12: Die op waterstof werken als donor.
- EN.C. 1.13: Die werken op eenvoudige donoren met de opname van moleculaire zuurstof (oxygenasen).
- EN.C. 1.14: Die werken op "gepaarde" donoren, met de opname of vermindering van moleculaire zuurstof.
- EN.C. 1.15: Welke fungeren op superoxiden als acceptoren.
- EN.C. 1.16: welke metaalionen oxideren.
- EN.C. 1.17: Welke handelen op CH2 -groepen.
- EN.C. 1.18: Welke handelen op eiwitten die ijzer bevatten en aannemen als donoren.
- EN.C. 1.19: Welke handelen op verminderde flavodoxine als donor.
- EN.C. 1.20: die handelen op donoren zoals fosfor en arseen.
- EN.C. 1.21: Welke werkt in de reactie X-H + Y-H = X-Y.
- EN.C. 1.22: Welke handelen op het halogeen van donoren.
- EN.C. 1.23: die C-O-C-groepen verminderen als acceptoren.
- EN.C. 1.97: Andere oxidoryductasen.
Elk van deze categorieën omvat ook subgroepen waarin enzymen worden gescheiden volgens de voorkeur van substraten.
Kan u van dienst zijn: primaire opvolging: kenmerken en voorbeeldenBijvoorbeeld, binnen de groep oxidoreductasen die op de Ch-OH-groepen van hun donoren werken, zijn er bijvoorbeeld enkele die de voorkeur geven aan NAD+ of NADP+ als acceptoren, terwijl anderen cytochromen, zuurstof, zwavel, etc. gebruiken.
Structuur
Omdat de groep oxidoreductasen extreem divers is, is het vaststellen van een gedefinieerd structureel kenmerk vrij ingewikkeld. De structuur ervan varieert niet alleen van enzym tot enzym, maar ook tussen soorten of groep levende wezens en zelfs cel tot cel in verschillende weefsels.
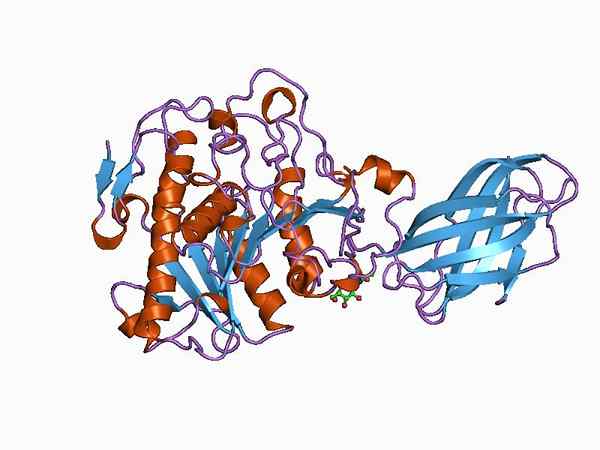
 Bioinformatica -model van de structuur van een oxyductase -enzym (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Bioinformatica -model van de structuur van een oxyductase -enzym (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Het enzympyruvaatdehydrogenase is bijvoorbeeld een complex bestaande uit drie opeenvolgend gekoppelde katalytische subeenheden en bekend als de E1 -subeenheid (dehydrogenase piruvaat), de E2 -subeenheid (dihydrolipamide acetyltransferase) en het E3 -subunit (dihydrolipamide -dhydrolipamide (dihydrolipamide -dhydrogenase).
Elk van deze subeenheden kan op zijn beurt worden samengesteld uit meer dan één eiwitmonomeer van hetzelfde type of van verschillende typen, dat wil zeggen dat ze homodimeer kunnen zijn (die met slechts twee gelijke monomeren), heterotrimérica (die drie verschillend monomeren hebben) enzovoort.
Het zijn echter meestal enzymen samengesteld uit alfahallen en β-vergulde vellen gerangschikt in verschillende vormen, met specifieke intermoleculaire interacties van verschillende soorten verschillende typen.
Functie
Oxidorteerde enzymen katalyseren oxide-reductiereacties vrijwel in alle cellen van alle levende wezens op de biosfeer. Deze reacties zijn in het algemeen omkeerbaar, waarbij de oxidatietoestand van een of meer atomen binnen hetzelfde molecuul wordt gewijzigd.
Meestal hebben de oxidorestonen twee substraten nodig, een die fungeert als een donor van waterstof of elektronen (die oxideert) en een andere die fungeert als een acceptor van waterstof of elektronen (die wordt verminderd).
Deze enzymen zijn uiterst belangrijk voor veel biologische processen in verschillende soorten cellen en organismen.
Ze werken bijvoorbeeld bij de synthese van melanine (een pigment dat wordt gevormd in de cellen van de huid van de mens), bij de vorming en afbraak van lignine (structurele verbinding van plantencellen), bij het vouwen van eiwitten, enz.
Het kan je van dienst zijn: soorten geïntroduceerd op de Galapagos -eilandenZe worden industrieel gebruikt om de textuur van sommige voedingsmiddelen te wijzigen en het voorbeeld hiervan zijn peroxidasen, oxidasglucose en andere.
Bovendien zijn de meest prominente enzymen van deze groep die die deelnemen als elektronische transporters in de transportketens van het mitochondriale membraan, chloroplasten en interne plasmamembraan van bacteriën, waar ze transmembranale eiwitten zijn.
Voorbeelden van oxidortas
Er zijn honderden voorbeelden van oxidorteerde enzymen in de natuur en de industrie. Deze enzymen hebben, zoals vermeld, functies van het grootste belang voor cellulair functioneren en daarom voor het leven per se.
Oxidiductasen omvatten niet alleen peroxidase -enzymen, lak, oxidaseglucose of dehydrogene alcohol; Ze combineren ook belangrijke complexen zoals het glyceraldehyde-enzym 3-fosfaatdehydrogenase of de complimenus dehydrogenase, enz., essentieel vanuit het oogpunt van glucosekatabolisme.
Het omvat ook alle enzymen van het elektronische transportcomplex in het interne mitochondriale membraan of in het interne membraan van bacteriën, vergelijkbaar met enkele van de enzymen die worden gevonden in de chloroplasten van plantenorganismen.
Peroxidasen
Peroxidasen zijn zeer diverse enzymen en gebruiken waterstofperoxide als elektronenacceptor om de oxidatie van een verscheidenheid aan substraten, waaronder fenolen, amines of thiolen, te katalyseren, onder andere. In zijn reacties verminderen ze waterstofperoxide totdat het water produceert.
Ze zijn erg belangrijk vanuit industrieel oogpunt, zijnde de peroxidase van de pittige radijs de belangrijkste en de meest bestudeerde van allemaal.
Biologisch gezien zijn peroxidasen belangrijk voor de eliminatie van reagenszuurstofverbindingen die aanzienlijke schade aan cellen kunnen veroorzaken.
Referenties
- Britannica Encyclopaedia. (2019). Ontvangen 26 december 2019, van www.Britannica.com
- Ercili-Cura, D., Hupperz, T., & Kelly, a. L. (2015). Enzymatische aanpassing van de textuur van zuivelproducten. Bij het wijzigen van voedseltextuur (PP. 71-97). Woodhead Publishing.
- Mathews, c. K., Van Holde, K. EN., & Ahern, k. G. (2000). Biochemie. TOEVOEGEN. Wesley Longman, San Francisco.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IBMB). (2019). Opgehaald van www.Qmul.AC.Uk/sbcs/iubmb/enzym/index.HTML
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, f. (2014). De pyruvaatdehydrogenase-complexen: structuurbasisfunctie en regulatie. Journal of Biological Chemistry, 289 (24), 16615-16623.

