Oxácido

- 2513
- 518
- Dr. Rickey Hudson
 Pertectaalezuurmolecuul, een zeer zeldzaam oxozuur van TecNecio. Bron: Jynto, Wikimedia Commons
Pertectaalezuurmolecuul, een zeer zeldzaam oxozuur van TecNecio. Bron: Jynto, Wikimedia Commons Wat is een oxacid?
A oxácido, U oxoacid, het is een zuur dat zuurstof bevat. Het is samengesteld uit waterstof, zuurstof en een niet -metalen element dat het zo -aangedekte centrale atoom vormt. Afhankelijk van het aantal zuurstofatomen, en daarom kunnen de oxidatietoestanden van het niet -metalen element verschillende oxacides vormen.
Oxcacides hebben een groot aantal toepassingen, die in het algemeen moeilijk te beschrijven zijn. De toepassing ervan hangt sterk af van het centrale atoom en het aantal zuurstof.
Ze kunnen dienen uit verbindingen voor synthese van materialen, meststoffen en explosieven, zelfs voor analytische doeleinden of productie van frisdranken, zoals optreedt bij koolzuur en fosforzuur, h3Po4, Deel uitmaken van de samenstelling van deze drankjes.
Kenmerken en eigenschappen van oxcacid
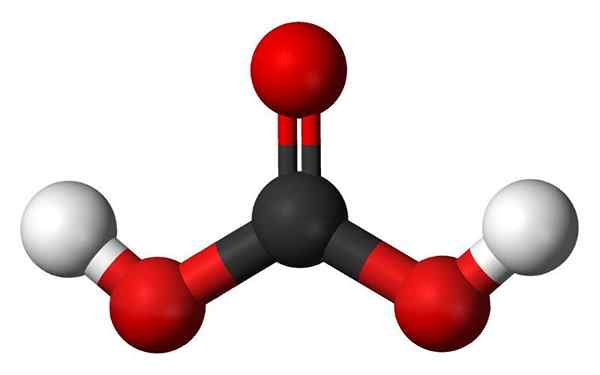 Koolzuurmolecuul. Bron: Jynto en Ben Mills, Wikimedia Commons
Koolzuurmolecuul. Bron: Jynto en Ben Mills, Wikimedia Commons - Hydroxylgroepen: Een van de belangrijkste kenmerken van een oxácido is niet alleen dat het zuurstof heeft, maar dit is ook als een OH -groep. Aan de andere kant hebben sommige oxacides wat een Oxo -groep wordt genoemd, E = O. In het geval van fosforzuur heeft het een Oxo -groep, P = O. Ze missen H -atomen, dus "ze zijn niet verantwoordelijk" voor de zuurgraad.
- Centraal atoom: Het centrale atoom (E) kan al dan niet een elektronegatief element zijn, afhankelijk van de locatie in blok P van het periodiek systeem. Aan de andere kant trekt zuurstof, een iets meer elektronegatief element dan stikstof, de elektronen van de OH -binding aan, waardoor de afgifte van de ion H mogelijk is+. E is daarom gekoppeld aan OH -groepen. Wanneer een ion H wordt vrijgegeven+ Zure ionisatie treedt op, dat wil zeggen, het verwerft een elektrische lading, die in zijn geval negatief is. Een oxcacid kan zoveel H -ionen vrijgeven+ Zoals OH -groepen in zijn structuur hebben, en hoe meer er zijn, hoe groter de negatieve belasting zal zijn.
- Zure kracht: De kracht van bijna alle oxacides met hetzelfde centrale atoom (geen metaal), neemt toe met de toename van de oxidatiestatus van het centrale element, die op zijn beurt direct verband houdt met de toename van het aantal zuurstofatomen.
Er worden bijvoorbeeld drie oxacid -series getoond waarvan de zuurgraad van de minste tot de grootste worden geordend:
H2SW3 < H2SW4
Hno2 < HNO3
HCLO < HClO2 < HClO3 < HClO4
In de meeste oxacides met verschillende elementen met dezelfde toestand van oxidatie, maar behorend tot dezelfde groep van het periodieke tabel, neemt de zuurgraadkracht direct toe met de elektronegativiteit van het centrale atoom:
H2SEO3 < H2SW3
H3Po4 < HNO3
Hbro4 < HClO4
Oxcacidevorming
Zoals in het begin vermeld, worden oxácidos gegenereerd wanneer bepaalde stoffen, zuuroxiden worden genoemd, reageren met water. Dit wordt uitgelegd met hetzelfde voorbeeld van koolzuur.
Co₂+h₂o h2CO3
Zuuroxide + water => oxácido
Wat er gebeurt, is dat H₂o's molecuul covalent bindt met dat van co₂. Als water wordt geëlimineerd door warmte, de balans naar de regeneratie van de co₂bewegingen, dat wil zeggen dat een hete frisdrankje binnenkort zijn bruisende sensatie verliest dan een verkoudheid.
Aan de andere kant worden zuuroxiden gevormd wanneer een niet -metalen element reageert met water, hoewel, meer precies, wanneer het reagerende element een oxide vormt met een covalent karakter, waarvan de oplossing in water hones genereert+.
Er is al gezegd dat de ionen h+ Ze zijn het product van de resulterende oxacid -ionisatie.
Trainingsvoorbeelden
Het chlooroxide, Cl2OF5, Reageer met water om het chloorzuur te geven:
Klet2OF5 + H₂o => hclo3
Zwaveloxide, dus3, Reageert met water om zwavelzuur te vormen:
SW3 + H₂o => h2SW4
En het periódic -oxide, ik2OF7, reageert met water om het periódiczuur te vormen:
Je2OF7 + H₂o => hio4
Naast deze klassieke mechanismen voor oxacidevorming zijn er andere reacties voor hetzelfde doel.
Kan u van dienst zijn: endotherme reactieBijvoorbeeld fosfor -trichloride, PCL3, Het reageert met water om fosforzuur, een oxácido en zoutzuur te produceren, een halohydrinezuur.
PCL3 + 3H2O => H3Po3 + HCl
En fosfor pentachloride, pcl5, reageert met water om fosforzuur en zoutzuur te geven.
PCL5 + 4 H₂o => H3Po4 + HCl
Metaal oxcacides
Sommige overgangsmetalen vormen zure oxiden, dat wil zeggen dat ze in het water oplossen om oxacides te geven.
Mangaanoxide (vii) (permanganisch anhydrum) mn2OF7 En chroomoxide (VI) zijn de meest voorkomende voorbeelden.
Mn2OF7 + H₂o => hmno4 (permanganinezuur)
Cro3 + H₂o => h2Cro4 (chroomzuur)
Nomenclatuur
Valencia berekening
Om een oxácid correct aan te stellen. Beginnend met de generieke HEO -formule, wordt het volgende beschouwd:
- De O heeft Valencia -2.
- De Valencia de los H es +1.
Met dit in gedachten, de oxácid. Dus je hebt de volgende algebraïsche som:
-2 + 1 + e = 0
E = 1
Daarom is E +1 Valencia.
Dan de mogelijke valenties die kunnen hebben en. Als een van hun valenties waarden +1, +3 en +4 zijn en vervolgens "werken" met zijn kleine Valencia.
Naam zuur
Om HEO te benoemen begint door het zuur te noemen, gevolgd door de naam van E met de achtervoegsels -ICO, als u werkt met de grootste Valencia, of -ono, als u met de minderjarige werkt. Wanneer er drie of meer zijn, worden de hypo-voorvoegsels gebruikt om te verwijzen naar de minderjarige en grotere van de valenties.
Zo zou Heo worden genoemd:
Zuur hik(Naam van E)beer
Omdat +1 de minste van zijn drie valenties is. En als het heo was2, Dan zou ik Valencia +3 hebben en het zou worden genoemd:
Het kan je van dienst zijn: difenylamineZuur (e)beer
En op dezelfde manier voor HEO3, Met E werken met Valencia +5:
Zuur (e)ICO
Voorbeelden
- Kroomzuur (h2Cr2OF4)). Het is een sterk, onstabiel zuur bij hoge temperaturen.
- Dicrominezuur (h2Cr2OF7)). De aanwezigheid ervan is merkbaar in chroomzuurmengsels die worden gebruikt om het glas schoon te maken.
- Hypochlorzuur (HCLO). Herstel snel huidweefsels.
- Brroomzuur (hbro2)). Het is een tussenliggende, onstabiele verbinding. Bromo -verbinding.
- Orthofosforzuur (h3Po4)). Irriterend zuur voor niet -brandstofhuid.
- Permanganinezuur (hmno4)). Zeer sterk zuur.
- Periódiczuur (HIO4)). In organische chemie wordt het gebruikt om de structuren van andere moleculen te analyseren.
- Brominezuur (hbro3)). Oxcacid van broom. Zijn zouten oxideren krachtig.
- Hypobrome zuur (HBRO). Het wordt gebruikt in verdunde waterige oplossing en wordt verkregen door reactie tussen water en de br2.
- Metafosforzuur (HPO3)). Zeer corrosief, kleurloos en toilet vast bij kamertemperatuur.
- Yodiumzuur (HIO3)). Reactief gebruikt om morfine in een product te detecteren.
- Zwavelzuur (h2SW3)). Acider Rain veroorzaken.
- Zwavelzuur (h2SW4)). Regelmatig voor metaalverwerking en meststoffen, het is een van de meest gebruikte chemische verbindingen.
- Salpeterzuur (HNO3)). Laboratoriumreagens, zeer gevaarlijk omdat het de huid kan verbranden.
- Chloorzuur (HCLO3)). Bij het ontleden produceert het veel producten. Het is koud stabiel tot een concentratie van 30%.
- Arseniosozuur (h3ASO3)). Bevat arseen en is zeer giftig en kankerverwekkend. Het wordt gebruikt in herbiciden en pesticiden.
- Ortosilicinezuur (h4SIO4)). Zwak zuur dat wordt gebruikt als ondersteunings- of droogmiddelmiddel.
- Koolzuur (h2CO3)). Het wordt gebruikt om frisdrank te maken.
- Stikstofzuur (HNO2)). In oplossing is het opmerkelijk gedissocieerd.
- Metaborinezuur (HBO2)). Licht oplosbaar kristallijne witte vaste stof.
Referenties
- Veel voorkomende oxoacid -verbindingen. Hersteld van ThoughtCo.com.

