Natriumoxalaat (NA2C2O4) structuur, eigenschappen, gebruik, risico's

- 1209
- 168
- Miss Herman Russel
Hij natriumoxalaat Het is een organische verbinding gevormd door twee natriumionen en een oxalaationen. De chemische formule is na2C2OF4 of ook na2(COO)2. Het is het natriumzout van oxaalzuur of ethanodioisch zuur. Dan een2C2OF4 Het is een kristallijne witte vaste stof en zijn waterige oplossingen zijn basic (alkalisch).
Natriumoxalaat is aanwezig in planten en groenten. In de mens wordt het op natuurlijke wijze gegenereerd uit zijn geconjugeerde zuuroxaalzuur, dat op zijn beurt wordt geproduceerd door bepaalde metabole processen.
 Natriumoxalaat NA2(COO)2 stevig. Lem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Natriumoxalaat NA2(COO)2 stevig. Lem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Dan een2C2OF4 Het wordt gebruikt in chemische analyse -laboratoria als een reductiemiddel (het tegenovergestelde van oxidatiemiddel). Ook om tests toe te staan voor bepaalde organische verbindingen tijdens afvalwaterbehandeling.
Het is gebruikt voor de eliminatie van chloorofluorocarbons afval (CGC), die de ozonlaag beschadigt. Het is ook grondstof om oxaalzuur op een economische manier te verkrijgen.
Vanwege het hoge natriumoxalaatgehalte van sommige eetbare groenten, moeten mensen die de neiging hebben om berekeningen of nierstenen te vormen, voorkomen dat dergelijke voedingsmiddelen worden geconsumeerd. Dit komt omdat de stenen over het algemeen worden gevormd met oxalaten.
[TOC]
Structuur
Natriumoxalaat bestaat uit twee natrium na kationen+ en een oxalaatanion (COO)22-. Oxalaatanion wordt op zijn beurt gevormd door twee COO- Samen met de twee koolstofatomen: -OOC-COO-.
In vast natriumoxalaat heeft oxalaatanion een platte vorm. Dit betekent dat zowel koolstofatomen als zuurstof in hetzelfde vlak worden gevonden.
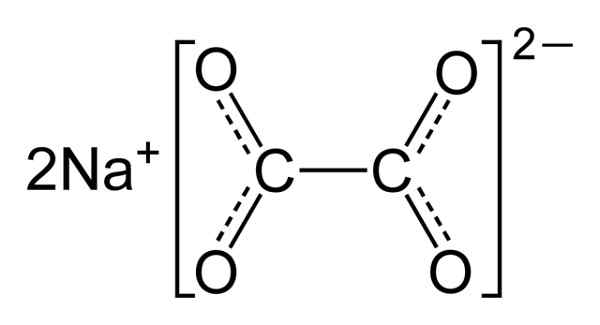 Chemische structuur van natriumoxalaat2(COO)2. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Chemische structuur van natriumoxalaat2(COO)2. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Nomenclatuur
- Natriumoxalaat
- Dysodio oxalaat
- Natriumzout van etanodioisch zuur
Eigenschappen
Fysieke staat
Kristallijne witte vaste stof.
Molecuulgewicht
134.0 g/mol
Dikte
2.27 g/cm3 bij 20 ° C.
Oplosbaarheid
Water oplosbaar: 3,7 g/100 ml bij 20 ° C.
pH
De waterige oplossingen zijn basic (alkalisch) omdat het oxalaatanion de neiging heeft om waterprotonen te nemen die de ionen oh vrij verlaat-.
Kan u van dienst zijn: neon: geschiedenis, eigenschappen, structuur, risico's, gebruikChemische eigenschappen
Het kan zuren neutraliseren en reacties zijn exotherme, dat wil zeggen, ze geven warmte af.
Het dient als een reductiemiddel en in deze reacties genereert het koolstofdioxide CO2.
Het heeft het eigendom van het samenvoegen van verschillende metaalionen zoals Ferro Iron Iions Faith2+ en ferrisch geloof3+.
Het verkrijgen van
Volgens een geraadpleegde bron kan natriumoxalaat worden verkregen oxiderende zuurstof of2 Bij een temperatuur van ongeveer 250 ° C in een geconcentreerde oplossing van NaOH -natriumhydroxide.
Aanwezigheid in de natuur
Natriumoxalaat is aanwezig in vele planten en groenten, zoals snijbiet, spinazie en Ruibarbo, en in granen zoals sojabonen, naast vele andere plantproducten.
 Spinazie heeft veel natriumoxalaat. Auteur: Aline Ponce. Bron: Pixabay.
Spinazie heeft veel natriumoxalaat. Auteur: Aline Ponce. Bron: Pixabay. Het geconjugeerde zuuroxaalzuur komt in het menselijk organisme voor door het metabolisme van glycolzuur of ascorbinezuur. Eenmaal geproduceerd wordt het niet gemetaboliseerd, maar wordt uitgescheiden door oxalaatvormige urine.
 Ruibarbo bevat natriumoxalaat. Auteurs: S. Hermann & F. Richter. Bron: Pixabay.
Ruibarbo bevat natriumoxalaat. Auteurs: S. Hermann & F. Richter. Bron: Pixabay. Toepassingen
In chemische analyse laboratoria
Het wordt gebruikt als een chemisch reagens, meestal als een reductiemiddel, bijvoorbeeld voor de standaardisatie van kaliumpermanganaatoplossingen, dat wil zeggen om precies te bepalen hoeveel natriumpermanganaat ze hebben.
In de vernietiging van chlorofluorocoolwaterstoffen
Natriumoxalaat is gebruikt voor de vernietiging van chlorofluorocoolwaterstoffen (CFC). Deze CFC -verbindingen zijn een van degenen die verantwoordelijk zijn voor de vernietiging van de ozonlaag van de planeet (die ons beschermt tegen ultraviolette straling).
In 1996 stelden sommige onderzoekers het gebruik van natriumoxalaat voor om ze te elimineren, omdat het gemakkelijk reageert met CFC bij temperaturen van 270-290 ° C, waardoor ze onschadelijke producten zijn naar de ozonlaag.
Natriumoxalaatreactie met CFC's kan worden geregeld om gehalogeneerde aromatische koolwaterstoffen te verkrijgen die niet schadelijk zijn voor de ozonlaag maar nuttige verbindingen zijn in de chemische industrie.
Het kan u van dienst zijn: propyleenglycol: structuur, eigenschappen, synthese en gebruikDeze reactie kan ook tot het maximum worden gebracht en de gehele CFC omzetten in NAF -natriumfluoride, soll natriumchloride, elementaire koolstof en koolstofdioxide CO in2.
 De ozonlaag van de planeet beschermt ons tegen de ultraviolette stralen van de zon. Met natriumoxalaat kunt u de CFC -verbindingen elimineren die deze beschadigen. Auteur: One94. Bron: Pixabay.
De ozonlaag van de planeet beschermt ons tegen de ultraviolette stralen van de zon. Met natriumoxalaat kunt u de CFC -verbindingen elimineren die deze beschadigen. Auteur: One94. Bron: Pixabay. Bij het bepalen van belangrijke parameters bij de behandeling van afvalwater
Er is gebleken dat natriumoxalaat nuttig is voor het meten van de hoeveelheid en klassen van organische verbindingen die de slibmicro -organismen scheiden om afvalwater te behandelen.
De maat voor dergelijke verbindingen is belangrijk om hun functie te bepalen tijdens de behandeling van afvalwater, omdat het gemak van het scheiden van de modder van het water ervan afhangt.
Met behulp van natriumoxalaat wordt het ongemak van andere methoden vermeden.
Om oxaalzuur te verkrijgen
Ruw natriumoxalaat van afval uit bepaalde processen is gebruikt om oxaalzuur H te produceren2C2OF4 in grote hoeveelheden.
De methode gebruikt slib uit het Bayer -proces om bauxiet (een aluminium mineraal) te behandelen. In het Bayer -proces wordt bauxiet behandeld met NaOH -natriumhydroxide om het aluminiumoxide van dit mineraal op te lossen.
In het proces van het oplossen van aluminiumoxide worden bepaalde organische verbindingen die aanwezig zijn in het mineraal, zoals humuszuren aangevallen door NaOH, waardoor een grote hoeveelheid natriumoxalaat na wordt2C2OF4.
Dit natriumoxalaat is opgenomen in een modder met aluminiumverbindingen. Om het te zuiveren, wordt de assemblage opgelost, wordt deze gefilterd en door een zure -type ionenuitwisseling geleid.
In de kolom is er een RSO sulfonzuurhars3H waar na -metalen ionen worden uitgewisseld+ door waterstofionen h+, Dus je krijgt oxaalzuur h2C2OF4.
RSO3H + Na2C2OF4 ⇔ RSO3Na + NAHC2OF4
Kan u van dienst zijn: kaliumcarbonaat (K2CO3): structuur, eigenschappen, gebruik, verkrijgenRSO3H + nahc2OF4 ⇔ RSO3Na + H2C2OF4
Dit is een economisch proces en het verkregen oxaalzuur is van acceptabele zuiverheid.
Om ongewenste verbindingen te verwijderen
Geconjugeerd natriumoxalaatzuur, oxaalzuur H2C2OF4, Het wordt gebruikt om bepaalde soorten afval en inlays op te lossen.
Het oxaalzuur -kenmerk van oxalaat wordt gebruikt als een complex of neerslagmiddel, bijvoorbeeld tijdens de verwerking van afval van verschillende nucleaire brandstoffen.
Oxaalzuur wordt ook gebruikt om de inlays van mineralen en ijzeroxiden in buizen en andere apparatuur te verwijderen, dit is te wijten aan het vermogen om zich sterk aan te sluiten bij het Ferrous Ion Faith2+ Als het ferrische iongeloof3+ Oxalates vormen.
Risico's
Als natriumoxalaat direct wordt ingeademd of ingenomen. Het produceert braken, ernstige zuivering, zwakke puls, cardiovasculaire instorting, neuromusculaire symptomen en nierschade.
Mensen die de neiging hebben om berekeningen in de nieren te vormen als gevolg van accumulatie van oxalaat in de urine, moeten voorkomen dat groenten worden geconsumeerd met een hoog gehalte aan oplosbare oxalaten zoals natrium.
Natriumoxalaat in grote hoeveelheden in voedsel bij het bereiken van urine bindt aan het calcium dat hierin aanwezig is en kan berekeningen of stenen van calciumoxalaat in de nieren produceren aan mensen die de neiging hebben om dit te doen.
 Natriumoxalaat van sommige voedingsmiddelen kan leiden tot de vorming van stenen in de nieren van mensen met aanleg ervoor. Auteur: Azwer. Bron: Pixabay.
Natriumoxalaat van sommige voedingsmiddelen kan leiden tot de vorming van stenen in de nieren van mensen met aanleg ervoor. Auteur: Azwer. Bron: Pixabay. Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Natriumoxalaat. Nationaal centrum voor biotechnologie -informatie. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Chai, W. En Liebman, m. (2005). Effect van verschillende kookmethoden op het oxalaatgehalte van groenten. J. Agrarisch. Food Chem. 2005, 53, 3027-3030. Hersteld van pubs.ACS.borg.
- Dagani, r. (1996). CFC die Reion vernietigt. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Hersteld van pubs.ACS.borg.
- Sajad, m. en kim, k.S. (2016). Extractie van extracellulaire polymere stoffen uit geactiveerd slib met behulp van natriumoxalaat. Inteken. J. Omgeving. Sci. Technol. 13, 1697-1706 (2016). Link hersteld.Springer.com.
- Jeffrey, G.NAAR. En Parry, g.S. (1954). De kristalstructuur van natriumoxalaat. J. BEN. Chem. SOC. 1954, 76, 21, 5283-5286. Hersteld van pubs.ACS.borg.
- Okuwaki, een. et al. (1984). Productie van oxalaat door de oxidatie van steenkool met zuurstof in een concentreerde natriumhydroxide -oplossing. Ind. Eng. Chem. Aanspringen. Rundvlees. Dev. 1984, 23, 648-651. Hersteld van pubs.ACS.borg.
- Hefter, g. et al. (2018). Soluubiliteit van natriumoxalaat in geconcentreerde elektrolytoplossingen. J Chem & Eng -gegevens. 2018, 63, 3, 542-552. Hersteld van pubs.ACS.borg.
- La K. Je. (1992). Proces voor het bereiden van oxaalzuur en natriumwaterstofoxalaat van ruw natriumoxalaat. OF.S. Patent nr. 5.171.887. December.15, 1992. Opgehaald van FreepatentsSonline.com.
- « Haptes History, Functions, Charactions, Inmunes Antwoorden
- Natrium tripolifosfaat (NA5P3O10) structuur, eigenschappen, gebruik, impact »

