Calciumoxalaat (CAC2O4) eigenschappen, structuur, gebruik, risico's
- 967
- 283
- Nathan Wiegand
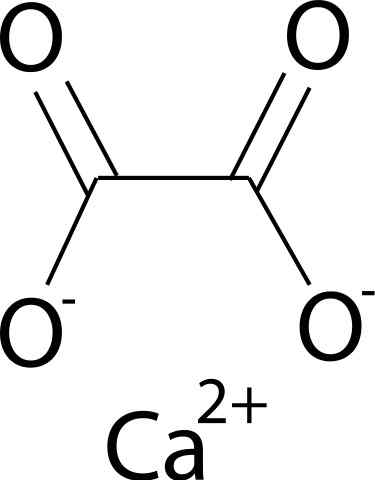
Hij Calciumoxalaat Het is een organische verbinding gevormd door koolstof (C), zuurstof (O) en calcium (Ca) elementen (CA) (CA). De chemische formule is CAC2OF4. Het wordt over het algemeen gevonden in zijn drie gehydrateerde vormen: mono-, di- en trihydraat. Dit is, met een, twee of drie watermoleculen respectievelijk in zijn kristallijne structuur.
Calciumoxalaat wordt gevonden in mineralen, planten, schimmels en andere levende wezens zoals zoogdieren en zelfs in mensen als gevolg van het metabolisme van sommige eiwitten. Het is te vinden in de urine van mensen en sommige dieren.
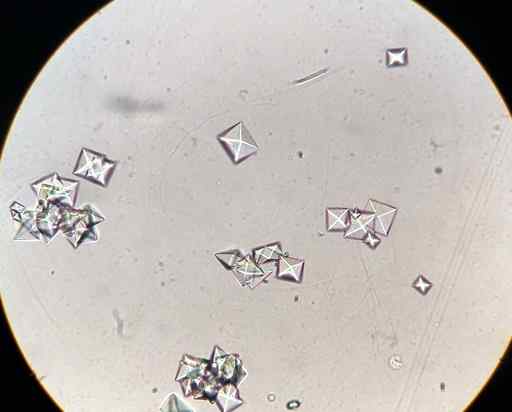 CAC -calciumoxalaatkristallen2OF4 In een urinemonster waargenomen met een microscoop. J3D3/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
CAC -calciumoxalaatkristallen2OF4 In een urinemonster waargenomen met een microscoop. J3D3/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Sommige voedingsmiddelen zoals spinazie, Ruibarbos, soja.
U kunt het uiterlijk van CAC -stenen vermijden2OF4 In de nieren als veel vloeistoffen worden ingenomen, vooral water, het vermijden van voedingsmiddelen met een hoog oxalaatgehalte en die rijk aan calcium en magnesium consumeren.
Calciumoxalaat vormt ongewenste inleg in buizen en procestanks zoals pulp- en papierproductie, en ook in bierfabrieken.
[TOC]
Structuur
Calciumoxalaat wordt gevormd door het calciumca -ion2+ en het oxalaat -ion c2OF42-. Oxalaatanion bestaat uit twee koolstofatomen en vier zuurstofatomen. De negatieve ladingen van oxalaatanion worden gevonden in zuurstofatomen.
 Chemische structuur van calciumoxalaat. Vsimonian/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/2.5). Bron: Wikimedia Commons.
Chemische structuur van calciumoxalaat. Vsimonian/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/2.5). Bron: Wikimedia Commons. Nomenclatuur
- Calciumoxalaat
- Oxaalzuur calciumzout
- Calciumzout van etanodioïnezuur
Eigenschappen
Fysieke staat
Kleurloos kristallijn, wit, geel of bruin die in drie verschillende gehydrateerde vormen kunnen zijn.
Molecuulgewicht
128,1 g/mol
Smeltpunt
Calciumoxalaatmonohydraat ontleedt tot 200 ° C.
Specifiek gewicht
CAC -monohydraat2OF4 •H2O = 2,22 g/cm3
CAC dihydraat2OF4 •2h2O = 1,94 g/cm3
CAC -trihydraat2OF4 •3H2O = 1,87 g/cm3
Oplosbaarheid
Bijna onoplosbaar in water: 0,00061 g/100 g water bij 20 ° C. Monohydraat lost op in verdund zuur.
pH
Waterige calciumoxalaatoplossingen zijn zwak eenvoudig.
Chemische eigenschappen
Calciumoxalaat is het calciumzout van oxaalzuur. Dit is een natuurlijk secundair product van het metabolisme, dus het is zeer overvloedig in het menselijk lichaam en maakt deel uit van veel voedingsmiddelen.
Oxaalzuur en zijn geconjugeerde basis, oxalaat, zijn zeer geoxideerde organische verbindingen, met een krachtige chelerende activiteit, dat wil zeggen dat ze gemakkelijk kunnen worden gecombineerd met positieve ionen met +2 of +3 belastingen.
Kan u van dienst zijn: methyl- of Metilo -groepDe waterige oplossingen zijn zwak eenvoudig omdat het oxalaat -ion de neiging heeft protonen te nemen h+ van water, dat oh ionen vrijgeeft-. Na het nemen van twee protonen h+ Het oxalaation wordt oxaalzuur h2C2OF4:
C2OF42- + H2O → HC2OF4- + Oh-
HC2OF4- + H2O → H2C2OF4 + Oh-
Aanwezigheid in de natuur
In mineralen
Calciumoxalaat is het meest voorkomende oxalaat en wordt gepresenteerd in de vorm van mineralen genaamd whewellita, Weddellita en Caoxite.
Whewellita is cac monohydraat2OF4 •H2Of en is de meest stabiele van de vormen van deze verbinding.
 Whewellita mineral rock. Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Whewellita mineral rock. Rob Lavinsky, irocks.com-cc-by-sa-3.0/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. De Weddellita is de CAC -dihydraat2OF4 •2h2O en is minder stabiel dan monohydraat.
 Weddelite minerale kristallen. Leon Hupperichs/CC door (https: // creativeCommons.Org/licenties/door/3.0). Bron: Wikimedia Commons.
Weddelite minerale kristallen. Leon Hupperichs/CC door (https: // creativeCommons.Org/licenties/door/3.0). Bron: Wikimedia Commons. Caxita is de calciumoxalaat TrihyDrado CAC2OF4 •3H2OF.
In planten en schimmels
Calciumoxalaat wordt geassocieerd met droge bodems en bladeren, ook met ziekteverwekkers, vrije, symbiose of planten geassocieerd met planten. In het laatste geval worden kristallen gevormd door de neerslag van calcium in de vorm van zijn oxalaat.
CAC -vorming2OF4 Voor schimmels heeft het een belangrijke invloed op de biologische en geochemische processen van bodem, omdat het een calciumreserve voor het ecosysteem vormt.
Aanwezigheid in het menselijk lichaam en bij zoogdieren
Oxalaat is afkomstig van de lever, in de rode of erytrocytbloedcellen en in kleinere hoeveelheid in de nier. Het wordt gevormd uit het metabolisme van aminozuren (zoals fenylalanine en tryptofaan) en door oxidatie van de glioxale dialdehyde,.
Vitamine C kan ook oxalaat worden bij het uitvoeren van de antioxidantfunctie.
Calciumoxalaat wordt gevonden in de stenen die worden gevormd in de nieren van mensen of dieren met nierziekte.
De SO -gekalde calciumoxalaatberekeningen of stenen worden gevormd door de kristallisatie of aggregatie van de CAC2OF4 In de totale urine met calcium en oxalaat. Dit betekent dat urine zowel calcium als oxalaat bevat dat het niet mogelijk is dat deze verbinding opgelost blijft, maar neerslaat of doorgaat naar de vaste toestand in de vorm van kristallen.
In mensen
De vorming van zand of stenen in de nieren is een ziekte genaamd nefrolithiasis; Het valt ongeveer 10% van de bevolking aan en ongeveer 75% van deze stenen bestaat uit calciumoxalaat CAC2OF4.
 Calciumoxalaat kan stenen vormen in de nieren. Auteur: vsrao. Bron: Pixabay.
Calciumoxalaat kan stenen vormen in de nieren. Auteur: vsrao. Bron: Pixabay. De vorming en groei van calciumoxalaatkristallen in de nier treden op omdat bij sommige mensen de urine oververzadigd is met genoemde zout. Calciumoxalaat ontwikkelt zich in zure urine bij pH minder dan 6,0.
Kan u van dienst zijn: isóbarosSupeaturatie treedt op wanneer de uitscheiding of eliminatie van dit zout (dat zeer weinig oplosbaar is in water) door de urine plaatsvindt in een klein volume water.
Factoren die het uiterlijk van nierstenen beïnvloeden
Onder de factoren die de vorming van calciumoxalaatzand zijn, zijn overtollig calcium in urine of hypercalciurie, overtollig oxalaat in urine of hyperoxalurie, elementen afgeleid van voeding en de afwezigheid van remmers.
Overmatig oxalaat kan optreden wanneer grote hoeveelheden spinazie, ruw, soja, noten en chocolade worden ingenomen, onder andere voedingsmiddelen.
 Chocolade kan een bron van calciumoxalaat zijn en de voorkeur geven aan het uiterlijk van stenen in de nieren. Auteur: Alexander Stein. Bron: Pixabay.
Chocolade kan een bron van calciumoxalaat zijn en de voorkeur geven aan het uiterlijk van stenen in de nieren. Auteur: Alexander Stein. Bron: Pixabay. Er zijn echter stoffen die de vorming van stenen remmen of voorkomen. Onder de verbindingen die berekeningen vermijden, zijn kleine moleculen zoals citraat en pyrofosfaat, en grote moleculen zoals glycoproteïnen en proteoglycanen.
Manieren om de vorming van calciumoxalaatstenen te voorkomen
Een goede strategie om herhaling van zand of calciumoxalaatberekeningen te voorkomen, waaronder de toename van de vloeistofafname, toename van calciumrijke voedingsmiddelen (zoals zuivelproducten) en het beperken van tafelzout (NaCl), dierlijke eiwitten, dierlijke eiwitten en rijke maaltijden in oxalaat.
Bij dieren
Sinds het begin van het jaar 2000. Het lijkt erop dat dit afhangt van het type voedsel dat deze dieren innemen en te maken hebben met de zuurgraad van urine en magnesiumgebrek (MG).
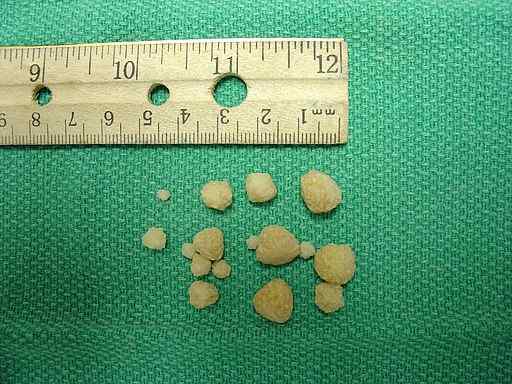 Calciumoxalaatstenen gevonden in de urineblaas van een hond. Joel Mills/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/). Bron: Wikimedia Commons.
Calciumoxalaatstenen gevonden in de urineblaas van een hond. Joel Mills/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/). Bron: Wikimedia Commons. Lichaamsrespons op overtollig oxalaat
Er zijn aanwijzingen dat zowel mensen als dieren reageren op overtollig oxalaat door het aantal bacteriën te vergroten dat oxalaat kan afbreken.
Sommige van deze bacteriën zijn Oxalobacter Formigenes, Bifidobacterium sp., Porphyromonas gingivalis En Bacillus SP., onder andere, en zijn van nature aanwezig in de darm.
Toepassingen
Volgens de geraadpleegde bronnen wordt calciumoxalaat gebruikt in keramische coating.
Het is gebruikt om sculpturen en andere artistieke elementen van kalksteen te dekken, en er is gebleken dat het de hardheid van het materiaal verbetert, zijn porositeit vermindert en zijn weerstand tegen zuren en alkalisten verhoogt.
 In Italië is het ervaren in het bedekken van objecten kalksteen van musea met calciumoxalaat om ze te behouden. Auteur: Bron: Moni Quayle. Pixabay.
In Italië is het ervaren in het bedekken van objecten kalksteen van musea met calciumoxalaat om ze te behouden. Auteur: Bron: Moni Quayle. Pixabay. Problemen in sommige processen
In de pulp- en papierindustrie kan calciumoxalaat inlays vormen die in het proces veel problemen veroorzaken.
Om de vorming ervan in industriële proceskanalen of leidingen te voorkomen.
Het kan u van dienst zijn: Cobalt -chloride (COCL2 (: Structuur, Nomenclatuur, EigenschappenHet heeft ook de neiging zich te accumuleren als steen in de containers waar bier wordt vervaardigd, waar het moet worden geëlimineerd om de vorming van micro -organismen te voorkomen die een onaangename smaak kunnen geven aan drinken.
Risico's
In hoge concentraties kan oxalaat de dood veroorzaken bij dieren en af en toe bij mensen voornamelijk vanwege de corrosieve effecten.
De accumulatie van oxalaat en zijn geconjugeerde zuur, oxaalzuur, kan aandoeningen veroorzaken zoals hartstoring, calciumoxalaatstenen, nierfalen en zelfs de dood door toxiciteit.
Referenties
- Glasauer, s.M. et al. (2013). Metalen en metalloïden, transformatie door micro -organismen. Oxalaten. In referentiemodulatie in aardsystemen en milieuwetenschappen. Hersteld van Scientedirect.com.
- Baumann, J. M. en Casella, r. (2019). Preventie van calciumnefrolithiasis: de invloed van diurese op calciumoxalaatkristallisatie in urine. Adv previum, 2019; 2019: 3234867. NCBI hersteld.NLM.NIH.Gov.
- Breshears, m.NAAR. en overleggen, aan.W. (2017). Het urinestelsel. Calciumoxalaat calculi. In pathologische basis van veterinaire aandoeningen (zesde editie). Hersteld van Scientedirect.com.
- Huang, en. eh al. (2019). TGE -hantering van oxalaat in TGE -lichaam en TGE -oorsprong van oxalaat in calciumoxalaatstonen. Urol Int, 2019 5 december: 1-10. NCBI hersteld.NLM.NIH.Gov.
- Nilvebrant, n.-OF. et al. (2002). Biotechnologie in de pulp- en papierindustrie. In uitvoering in biotechnologie. Hersteld van Scientedirect.com.
- Pahira, J.J. En Pevzner, m. (2007). Nephrolithiasis. Calciumstenen. In Penn Clinical Manual of Urology. Hersteld van Scientedirect.com.
- Worcester, E. M. (1994). Urine -calciumoxalaatkristalgroeiremmers. J Am Soc Nephrol 1994 nov; 5 (5 Suppl 1): S46-53). Hersteld van Jasn.Asnjournals.borg.
- Finkielstein, v.NAAR. en Goldfarb, D.S. (2006). Strategieën voor het voorkomen van calciumoxalaatstenen. NCBI hersteld.NLM.NIH.Gov.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Calciumoxalaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Pik, a.B. et al. (2015). Oxalaat-graading micro-organismen of oxalaat-graad-enzymen: wat is de toekomstige therapie voor enzymatische oplossing van calcium-oxalaat-urolieten bij terugkerende stenen ziekte? Urolithiasis, 2016 feb; 44 (1): 27-32. NCBI hersteld.NLM.NIH.Gov.
- Holames, r.P. et al. (2016). Urine -oxalaatuitscheiding verlagen om calciumoxalaatsteendiepar te bepalen. Urolithiasis. 2016 februari; 44 (1); 27-32. NCBI hersteld.NLM.NIH.Gov.
- Cyzar, t.M. (1998). Calciumoxalaat: een oppervlaktebehandeling voor kalksteen. Journal of Conservation and Museum Studies 4, PP.6-10. Opgehaald van JCMS-Journal.com.
- Wikimedia (2019). Calciumoxalaat. Opgehaald van.Wikipedia.borg.
- « Kwalitatieve onderzoekskenmerken, typen, technieken, voorbeelden
- Functionalisme (psychologie) oorsprong, kenmerken en vertegenwoordigers van auteurs »

