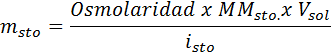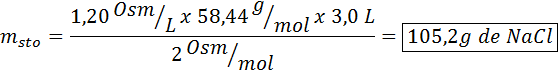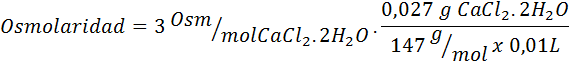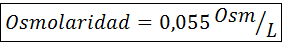Osmolariteit
- 2954
- 269
- Dewey Powlowski
Wat is osmolariteit?
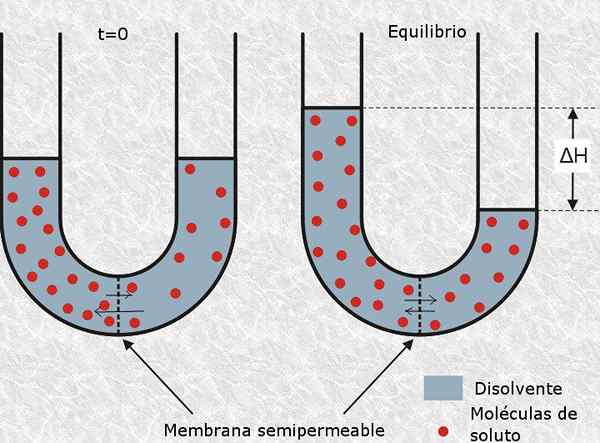
De Osmolariteit Het is een concentratie -eenheid die de molaire concentratie van de set osmotisch actieve deeltjes in een oplossing aangeeft. Met andere woorden, osmolariteit is de molariteit van osmotisch actieve deeltjes.
is gedefinieerd als osmotisch actief deeltje naar dat neutrale of ionmolecuul dat geen semipermeabiel membraan kan overschrijden, zoals het celmembraan. De aanwezigheid van dit type deeltjes genereert osmotische druk in de oplossing, en dus zijn naam.
Het aantal mol osmotisch actieve deeltjes wordt genoemd Osmolen (weergegeven door het OSM -symbool), dus osmolariteit wordt uitgedrukt in eenheden van OSM/L.
Het belang van osmolariteit
Osmolariteit is een concept van groot belang voor biologie en geneeskunde, omdat de osmotische balans van cellen met hun omgeving essentieel is voor hun overleving. Het injecteren van een oplossing met een zeer hoge of zeer lage osmolariteit intraveneus, kan gemakkelijk de dood aan een patiënt veroorzaken.
 Osmolariteit is een essentieel aspect van oplossingen in de geneeskunde en biologie
Osmolariteit is een essentieel aspect van oplossingen in de geneeskunde en biologie Aan de andere kant is een veel voorkomende techniek die celbiologen gebruiken om cellen van verschillende typen te breken via osmotische lysis. Dit bestaat uit het plaatsen van de cellen in een hypotone oplossing (met een zeer lage osmolariteit) zodat het water van de oplossing hen doordringt door osmose en barst ze uit.
Dit maakt het erg belangrijk, zowel voor artsen als voor biologen en professionals uit andere gebieden, weten, meten of weten hoe de osmolariteit van een oplossing te berekenen.
Kan u van dienst zijn: percentageconcentratieVerschillen tussen osmolariteit en osmolaliteit
Als u het over osmolariteit hebt, is het ook noodzakelijk om over osmolaliteit te praten. Osmolaliteit is vergelijkbaar met osmolariteit, op dezelfde manier als moraliteit vergelijkbaar is met molariteit.
Terwijl osmolariteit de Aantal osmoles per liter oplossing (OSM/L), Osmolaliteit geeft hetzelfde aan, maar Voor elk kilogram oplosmiddel (OSM/kg).
Osmolaliteit heeft het voordeel dat, niet afhankelijk van het volume van de oplossing, noch afhangt van de dichtheid of temperatuur. Om deze reden zal een oplossing dezelfde osmolaliteit hebben bij 25 ° C als bij 37 ° C. Aan de andere kant zal de osmolariteit van 37 ° C iets lager zijn dan zijn osmolariteit bij 25 ° C, vanwege de toename van de thermische expansievolume.
Osmolaraliteit is meestal gemakkelijker te meten experimenteel dan osmolariteit. Osmolariteit is echter gemakkelijker te berekenen en is een gemakkelijkere eenheid om te werken wanneer verdunningen worden voorbereid.
Hoe wordt de osmolariteit van een oplossing berekend?
Er zijn verschillende manieren om de osmolariteit van een oplossing te berekenen, afhankelijk van de meetinstelling die wordt geteld. Het kan worden berekend op basis van:
- De hoeveelheden opgeloste stof en oplossing.
- De molariteit van de aanwezige opgeloste stoffen.
- Individuele ionenconcentraties.
- Onder andere het percentage m/v van de opgeloste stoffen.
In alle gevallen is de berekening gebaseerd op de algemene formule van osmolariteit, namelijk:

Waar NOsm Het is het aantal osmolen dat aanwezig is in de oplossing en Vzon Het is het volume van hetzelfde uitgedrukt in liters. Het aantal osmolen wordt berekend door het aantal mol in de opgeloste stof te vermenigvuldigen met het aantal deeltjes waarin het in oplossing dissocieert.
Kan u van dienst zijn: heterogene mengsels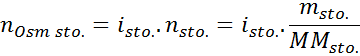
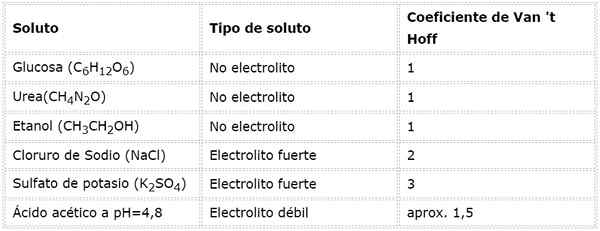
In deze vergelijking, Nsto Het is het aantal mol opgeloste stof, Msto is zijn massa (in g), Mmsto Het is zijn molaire massa (in g/mol) en Jesto Het is de coëfficiënt van het van de opgeloste stof. Deze coëfficiënt heeft een waarde van 1 voor niet -elektrolyten opgeloste stoffen (Zoals glucose bijvoorbeeld).
Voor sterke elektrolyten die volledig zijn gedissocieerd (zoals natriumchloride, NaCl) is de van 't hoffcoëfficiënt gelijk aan het totale aantal ionen waarin elke mol van de verbinding dissocieert.
Bijvoorbeeld in het geval van kaliumsulfaat, k2SW4, wiens dissociatiereactie is:
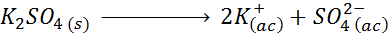
Elke mol van het zout dat oplost, produceert 3 mol ionen (2 K -ionen+ En 1 dus ion42-), vandaar I = n = 3.
In het geval van zwakke elektrolyten is de berekening ingewikkelder, maar ze worden meestal experimenteel bepaald. De volgende tabel vat de coëfficiënten van Van 't hoff samen voor een aantal gemeenschappelijke opgeloste stoffen.
Osmolariteitsberekeningsvoorbeelden
1. voorbeeld 1
Bepaal de osmolariteit van een voorbereide oplossing door 10 g NaCl en 10 g glucose op te lossen in 100 ml oplossing
Oplossing: In dit geval worden de osmolen van elke opgeloste stof afzonderlijk berekend en voegt u vervolgens toe. De molaire massa's zijn respectievelijk 58,45 g/mol en 180 g/mol, en de ve hoff -coëfficiënten zijn 2 en 1:
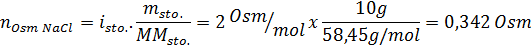
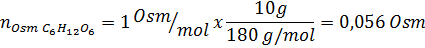
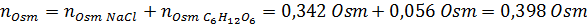
Nu berekenen we de osmolariteit met behulp van de formule, wetende dat 100 ml gelijk is aan 0,100l:
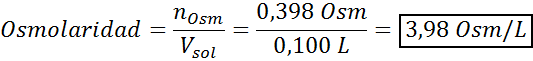
Ten slotte is de osmolariteit van de oplossing 3,98 OSM/L.
2. Voorbeeld 2
Bepaal de osmolariteit van een 0,05 oplossing kaliumsulfaatmolaire kaliumsulfaat.
Oplossing: Als we de molariteit van de opgeloste stof al kennen, is het berekenen van de osmolariteit zo eenvoudig als deze concentratie vermenigvuldigen met de van 't hoff -factor.
Kan je van dienst zijn: benzaldehyde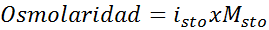
In dit geval is de zoutfactor 3.
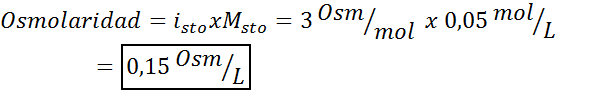
3. Voorbeeld 3
Bepaal de osmolariteit van een plasmamonster dat 0,125 M natriumionen, 0,020 m kaliumionen en 0,145 chloride -ionen bevat.
Oplossing: De osmolariteit van de individuele ionen is gelijk aan hun molariteit, omdat de ionen niet meer dissociëren en een I = 1. Om deze reden is het in dit geval alleen nodig om zich te vermenigvuldigen met I = 1 Elke concentratie en voeg toe:
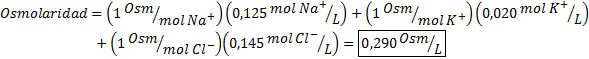
4. Voorbeeld 4
Bereken de osmolariteit van een oplossing die 27 mg cap bevat2.2h2Of voor elke 10 ml oplossing
Oplossing: Het cochl -molecuulgewicht2.2h2Of het is 147 g/mol. Tijdens het oplossen is dit zout gescheiden in 2 watermoleculen en drie ionen. Watermoleculen zijn echter geen osmotisch actieve deeltjes, dus ze worden niet in aanmerking genomen voor de berekening van osmolariteit, en de coëfficiënt voor deze verbinding is 3.

5. Voorbeeld 5
Welke massa natriumchloride is nodig om 3 liter oplossing te bereiden waarvan de osmolariteit 1,20 OSM/L is?
Oplossing: In dit geval, aangezien de massa opgeloste stof wordt gevraagd en we het volume en de concentratie hebben, is het voldoende om de massa van de osmolariteitsformule te wissen.