Kwantumnummers voor wat het nut is en wat zijn
- 1814
- 240
- Dewey Powlowski
De NKwantummeters Ze worden gebruikt om de kwantumtoestand van de elektronen in het atoom te beschrijven en ontstaan in de oplossing van de Schrödinger -vergelijking voor de eenvoudigste van allemaal: de waterstof.
De vergelijking van Schrödinger is een differentiaalvergelijking, waarvan de oplossingen zijn Golffuncties en ze worden aangeduid met de Griekse brief ψ. Oneindige oplossingen kunnen worden verhoogd en het vierkant is gelijk aan de waarschijnlijkheid om het elektron te vinden in een klein gebied van ruimte, genaamd orbitaal.
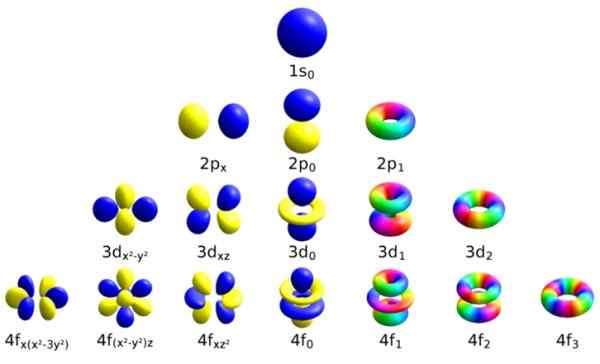
 Elk van deze atomaire orbitalen wordt onderscheiden door een bepaalde set kwantumnummers. Bron: Wikimedia Commons.
Elk van deze atomaire orbitalen wordt onderscheiden door een bepaalde set kwantumnummers. Bron: Wikimedia Commons. Elk orbitaal heeft kenmerken gedefinieerd die het onderscheiden van anderen, zoals energie, hoekmomentum en spin, een volledig kwantumeigenschap van het elektron en die onder andere verantwoordelijk is voor magnetische effecten.
De manier om elk orbitaal te identificeren is om het te onderscheiden door een reeks getallen die het beschrijven, en dit zijn precies de kwantumnummers:
-N: is het belangrijkste kwantumnummer.
-ℓ: het azimutale kwantumnummer.
-Mℓ, Het is het magnetische nummer.
-MS, Het spinnummer.
[TOC]
Waar zijn kwantumnummers voor?
Kwantumaantallen dienen om de staat van elektronen in de atoom te beschrijven. Dat atoommodel waarin het elektron zich omdraait, is onnauwkeurig, omdat het niet consistent is met atomaire stabiliteit of met een groot aantal waargenomen fysische fenomenen.
Dat is de reden waarom Deense Niels Bohr (1885-1962) in 1913 een gewaagd voorstel heeft gedaan: het elektron kan alleen worden gevonden in bepaalde stabiele banen, waarvan de grootte afhankelijk is van een geheel getal dat N wordt genoemd.
Later, in 1925, verhoogde de Oostenrijkse fysieke Erwin Schrödinger (1887-1961) een differentiaalvergelijking in gedeeltelijke derivaten, waarvan de oplossingen het waterstofatoom beschrijven. Zijn de golffuncties ψ genoemd in het begin.
Deze differentiaalvergelijking omvat de drie ruimtelijke coördinaten plus tijd, maar wanneer deze niet is opgenomen, is de oplossing van de Schrödinger -vergelijking analoog aan die van een stationaire golf (een golf die zich tussen bepaalde limieten verspreidt).
Golffuncties
Schrödinger's onafhankelijke tijdvergelijking wordt opgelost in bolvormige coördinaten en de oplossing is geschreven als het product van drie functies, één voor elke ruimtelijke variabele. In dit coördinatensysteem, in plaats van de coördinaten van de Cartesiaanse assen te gebruiken X, En En Z Coördinaten worden gebruikt R, θ En φ. Op deze manier:
Kan u van dienst zijn: parallel circuitψ (r, θ, φ) = r (r) ⋅f (θ) ⋅G (φ)
De golffunctie is ongrijpbaar, ondanks de kwantummechanica vertelt het ons die vierkante amplitude:
| ψ (r, θ, φ) |2
Dat wil zeggen dat de module of absolute waarde van de golffunctie, in het kwadraat, een reëel getal is dat de kans vertegenwoordigt om het elektron te vinden, in een bepaald gebied rond het punt waarvan de coördinaten zijn R, θ En φ.
En dit feit is iets concreet en tastbaarder.
Om de golffunctie te vinden, moet u drie gewone differentiaalvergelijkingen oplossen, één voor elke variabele R, θ En φ.
De oplossingen van elke vergelijking, die de functies r (r), f (θ) en g (φ) zullen zijn, bevatten de eerste drie kwantumnummers die worden genoemd.
Wat zijn de kwantumnummers?
Hieronder beschrijven we kort de aard van elk kwantumnummer. De eerste drie, zoals hierboven vermeld, komen voort uit de oplossingen van de Schrödinger -vergelijking.
Het vierde nummer werd toegevoegd door Paul Dirac (1902 - 1984) in 1928.
Hoofdkwantumnummer
Het wordt aangeduid door N en geeft de grootte van het toegestane orbitaal aan, evenals de energie van het elektron. Hoe hoger zijn waarde, hoe meer het elektron van de kern is en zijn energie zal ook zijn, maar in ruil daarvoor vermindert het zijn stabiliteit.
Dit aantal komt voort uit de R (R) -functie, wat de kans is om het elektron op een bepaalde afstand te vinden R van de kern, die wordt bepaald door:

-Planck Constant: H = 6.626 × 10 -3. 4 J.S
-Elektronenmassa mEn = 9.1 × 10-31 kg
-Elektronenbelasting: e = 1.6 × 10-19 C.
-Elektrostatische constante: k = 9 × 10 9 N.M2/C2
Wanneer n = 1 overeenkomt met de Bohr -straal die ongeveer 5 waard is.3 × 10−11 M.
Behalve de eerste laag, zijn de andere onderverdeeld in subcaps of sub -niveaus. Elke laag heeft een energie in volt -elektron gegeven door:
Kan u van dienst zijn: mechanische golven: kenmerken, eigenschappen, formules, typen
- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- Of (n = 5)
- P (n = 6)
- Q (n = 7).
In theorie is er geen bovengrens voor n, maar in de praktijk wordt waargenomen dat het alleen n = 8 bereikt. De minst mogelijke energie komt overeen met n = 1 en is die van de Fundamentele staat.
Azimutaal kwantumnummer of hoekmomentum
Aangegeven door de cursieve letter, bepaalt dit getal de vorm van de orbitalen, bij het kwantificeren van de grootte van het orbitale hoekmomentum van het elektron.
U kunt bijvoorbeeld volledige en positieve waarden nemen tussen 0 en N-1, bijvoorbeeld:
-Wanneer n = 1, dan ℓ = 0 en er is een enkel subniveau.
-Als n = 2, dan kan ℓ 0 of 1 waard zijn, dus je hebt twee subniveaus.
-En als n = 3, dan ℓ veronderstelt waarden 0, 1 en 2 en er zijn 3 subniveau.
Het kan voor onbepaalde tijd worden gevolgd, hoewel zoals eerder vermeld, in de praktijk n bereikt tot 8. Sub -niveaus worden aangeduid met letters: S, P, D, F En G En ze nemen in energie toe.
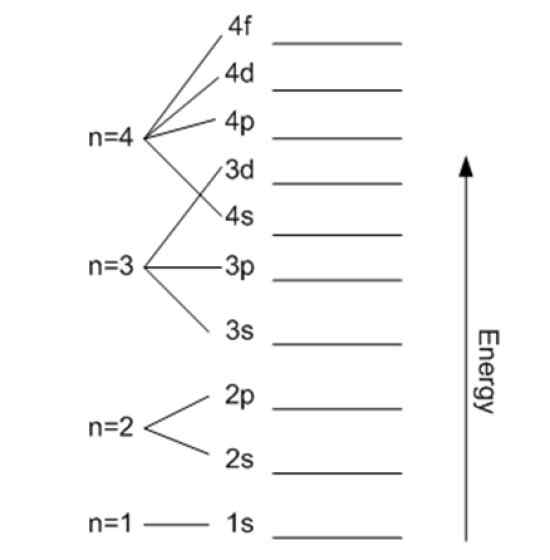 Energie is gerelateerd aan het belangrijkste kwantumnummer. Bron: Wikimedia Commons.
Energie is gerelateerd aan het belangrijkste kwantumnummer. Bron: Wikimedia Commons. Magnetisch kwantumnummer mℓ
Dit nummer bepaalt de oriëntatie van het orbitaal in de ruimte en de waarde ervan hangt af van de ℓ.
Voor een gegeven ℓ zijn er (2ℓ+1) hele waarden van m ℓ, overeenkomend met de respectieve orbitalen. Dit zijn:
-ℓ, ( - ℓ+1), ... 0, ... (+ℓ -1),+ℓ.
Voorbeeld
Als n = 2, weten we dat ℓ = 0 en ℓ = 1, dan m ℓ Neem de volgende waarden:
-Voor ℓ = 0: m ℓ = 0.
-Voor ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
De orbitale n = 2 heeft twee subniveau, de eerste met n = 2, ℓ = 0 en m ℓ = 0. Dan hebben we het tweede sub -niveau: n = 2, ℓ = 1, met 3 orbitalen:
- N = 2, ℓ = 1, m ℓ = -1
- N = 2, ℓ = 1, m ℓ = 0
- N = 2, ℓ = 1, m ℓ = +1
De drie orbitalen hebben dezelfde energie maar verschillende ruimtelijke oriëntatie.
Kwantum aantal spin mS
Bij het oplossen van de Schrödinger -vergelijking in drie dimensies, ontstaan de reeds beschreven getallen. Bij waterstof wordt echter een nog verdere structuur waargenomen dan deze getallen niet voldoende zijn om uit te leggen.
Het kan u van dienst zijn: GASE CONSTANT: Wat is berekening en voorbeeldenDaarom stelde in 1921 een ander lichaam, Wolfgang Pauli, het bestaan van een vierde nummer voor: het spinnummer mS, dat kost waarden van +½ of -½.
Met dit nummer wordt een zeer belangrijke eigenschap van het elektron beschreven, dat is de spinnen, woord dat uit het Engels komt spinnen (Draai jezelf om). En de spin is op zijn beurt gerelateerd aan de magnetische eigenschappen van het atoom.
Een manier om de spin te begrijpen is om je voor te stellen dat het elektron zich gedraagt als een kleine magnetische dipool (een magneet met noord- en zuidpalen), dankzij een rotatie rond zijn eigen as. De bocht kan in dezelfde richting zijn als de kloknaalden, of in de tegenovergestelde richting.
Hoewel Pauli het bestaan van dit aantal suggereerde, hadden de resultaten van een experiment uitgevoerd door Otto Stern en Walter Gerlach in 1922 er al op verwacht.
Deze wetenschappers slaagden erin om een straal zilveratomen te verdelen door de toepassing van een niet -uniform magnetisch veld.
De waarde van mS Het hangt niet af van n, ℓ en m ℓ. Grafisch wordt het weergegeven door een pijl: een opwaartse pijl geeft het schema aan en één langs de antihoran.
Pauli Exclusion Principle
Het gedrag van elektronen in het atoom is samengevat in het principe van uitsluiting van Pauli, waarin staat dat twee elektronen van een atoom niet in dezelfde kwantumtoestand kunnen bestaan.
Daarom moet elk elektron een andere set kwantumnummers n, ℓ, m hebben ℓ en MS.
Het belang van kwantumaantallen en dit principe ligt in het begrip van de eigenschappen van de elementen in het periodiek systeem: de elektronen zijn georganiseerd in lagen volgens N, en vervolgens in subcaps volgens ℓ en de rest van de getallen.
Referenties
- Alonso, m. 1971. Kwantum- en statistische stichtingen. Inter -American Educational Fund.
- Bauer, W. 2011. Fysica voor engineering en wetenschappen. Deel 1. MC Graw Hill.
- Chang, R. 2013. Scheikunde. 11VA. Editie. Mc Graw Hill Education.
- Eisberg-Resnick. 1989. Kwantumfysica. Limusa - Wiley.
- Giambattista, een. 2010. Natuurkunde. 2e. ED. McGraw Hill.
- Rex, a. 2011. Fundamentals of Physics. Pearson.
- Tippens, p. 2011. Fysica: concepten en toepassingen. 7e editie. McGraw Hill.
- « Beschuldiging geschreven inhoud, hoe het te doen, model
- Sedimentaire omgevingen en hun kenmerken, voorbeelden »

