Nitrieten eigenschappen, structuur, nomenclatuur, training
- 4055
- 270
- Dr. Rickey Hudson
De nitrieten Het zijn al die verbindingen die anion niet bevatten2-, Als ze anorganisch zijn, of de groep -ono, als ze organisch zijn. De overgrote meerderheid zijn metaalnitrieten, die anorganische zouten zijn waar nee2- interactie elektrostatisch met cationsN+; Bijvoorbeeld het natriumkation, na+.
Dus natriumnitriet, nano2, Het is een voorbeeld van een zout- of nitrietverbinding. Deze zouten worden in de natuur gevonden, hetzij in bodem, zeeën, zoogdieren en plantenweefsels, omdat ze deel uitmaken van de biologische cyclus van stikstof. Daarom nee2- Het is een substantie die aanwezig is in onze organismen en is gekoppeld aan vaatverwijdende processen.
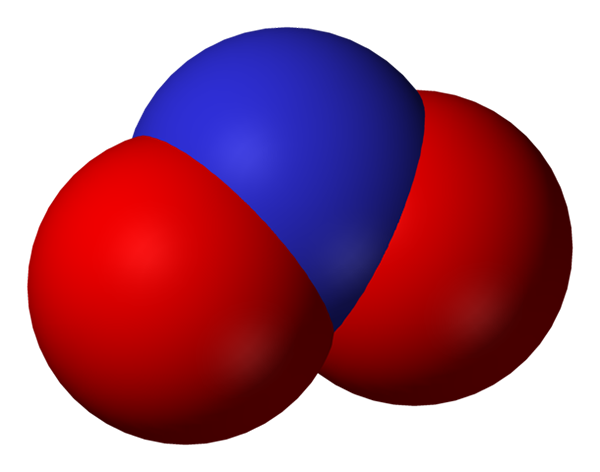
 Ruimte vol nitrietanion. Bron: Benjah-bmm27.
Ruimte vol nitrietanion. Bron: Benjah-bmm27. Nitriet wordt een kleinere vorm van stikstof, of minder geoxideerd, dan nitraat, niet3-. Stikstofmonoxide treedt uit, nee in gebieden van het organisme waar zuurstoftekort is. Hij is geen signaalmolecuul dat een vaatverwijdende effect uitoefent door spieren en slagaders te ontspannen.
Uit biochemie en geneeskunde worden nitrieten gebruikt als bactericiden, zijn hun aggregatie voor vrij gewoon vlees. Dit met als doel ze te genezen en hun kwaliteit en frisheid langer uit te breiden.
De nitriet heeft twee gezichten: een gunstig voor de gezondheid, en een andere die het in gevaar brengt. Het goede gezicht is juist te wijten aan de reacties die het verminderen tot niet. Ondertussen is het slechte gezicht te wijten aan de transformatie van nitrosamine: een familie van organische verbindingen met verschillende leden die zijn erkend als carcinogene stoffen.
[TOC]
Nitrieten eigenschappen
Basiciteit
Nitrieten zijn basische zouten, omdat anion dat niet doet2- Het is de geconjugeerde basis van het stikstofzuur, hno2:
Hno2 + H2Of ⇌ nee2- + H3OF+
In water en in een paar hoeveelheden wordt het gehydrolyseerd om oh ionen te ontstaan-:
NEE2- + H2Of ⇌ hno2 + Oh-
Deze basiciteit is intrinsiek voor alle nitrietzouten, omdat deze afhankelijk is van niet2- en niet van de kationen die hem vergezellen. Deze kationen en hun interacties met het nee2- Ze beïnvloeden de oplosbaarheid van nitrietzouten in water en andere polaire oplosmiddelen.
Reacties
Nitrieten reacties variëren afhankelijk van welke kationen het nee vergezellen2-, Of dat het een organische nitriet is, Rono. In het algemeen kunnen nitrieten ontbinden, oxideren of verminderen tot: metaaloxiden, niet3-, NEE2, Nee, en zelfs stikstofgas, n2.
Kan u van dienst zijn: thermodynamische processenBijvoorbeeld ammoniumnitriet, NH4NEE2 kan ontleden tot n2 en h2OF.
Fysieke verschijningen
Bijna alle nitrieten zijn vaste stoffen van kristallijn uiterlijk. Velen zijn witachtige of geelachtige kleuren, hoewel er kleurrijk is als ze overgangsmetalen kationen bevatten.
Aan de andere kant zijn meestal organische nitrieten zeer onstabiele en explosieve vluchtige vloeistoffen.
Structuur
Nitrietanion
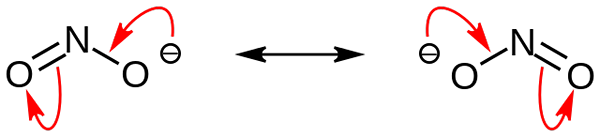 Nitrite anion resonantie structuren. Bron: Nohingserius / pub -domein
Nitrite anion resonantie structuren. Bron: Nohingserius / pub -domein In het eerste beeld werd het nitrietanion getoond met een vol space -model. Dit model heeft het nadeel dat precies hetzelfde is als dat van stikstofdioxide, nee2. Aan de andere kant beschrijft het superieure beeld de nitrietanion beter en hoe de negatieve belasting zich gedraagt.
Deze belasting wordt verplaatst tussen de twee zuurstofatomen, dus elk heeft de helft van genoemde negatieve belasting (-1/2). En het is deze negatieve last die verantwoordelijk is voor het aantrekken van omliggende kationen vanwege eenvoudige elektrostatische aantrekkingskracht.
Vaste stoffen
Anorganische nitrieten zijn allemaal kristallijne vaste verbindingen. De interacties zijn puur elektrostatisch, met een aantrekkingskracht tussen het nee2- en kationen mN+. Dus bijvoorbeeld de nano2 Het heeft een ortorrombische kristallijne structuur en wordt gevormd door naionen+ en niet2-.
Het type kristallijne structuur hangt af van de identiteit van M+N, Dus niet alle nitrieten delen een ortorrombische structuur.
Organische nitrieten
Organische nitrieten zijn, in tegenstelling tot anorganische. Ze worden daarom gevormd uit moleculen, die worden gekenmerkt door een R-AON-link, waarbij R een alkyl- of aromatische groep kan zijn.
Ze worden beschouwd als stikstofzuuresters, omdat hun waterstof, H-don, wordt vervangen door een R-groep:
 Algemene formule voor een organische nitriet. Bron: Pngbot via Wikipedia.
Algemene formule voor een organische nitriet. Bron: Pngbot via Wikipedia. Volgens het superieure beeld zou deze ester kunnen worden geschreven als rum = o, zeer vergelijkbaar met de formule van koolstofesters, roc = o. Let op de grote gelijkenis die deze structuur heeft met die van de nitroverbindingen, rno2, waar nu de hoofdlink is R-nee2 En niet R-dono. Het enige verschil ligt daarom in het atoom waarmee het lid wordt2 om R te groeperen.
Het is om deze reden dat nitrietesters en nitroverbindingen worden beschouwd als link -isomeren, omdat ze dezelfde atomen hebben, maar anders worden gekoppeld.
Complex
Nitrietcomplexen kunnen zowel anorganische als organische componenten hebben. Ze vormen een coördinatiekoppeling tussen een metaalcentrum en een van de geen zuurstof2-. Dat wil zeggen, er is geen sprake van een puur elektrostatische interactie, mN+NEE2-, Maar van coördinatie mN+-OF NIET-.
Kan u van dienst zijn: wat zijn de fysieke eigenschappen van materie?Organische nitrieten en hun complexen zullen al dan niet kristallijne structuren vaststellen, afhankelijk van of hun interacties erin slagen hun deeltjes in de ruimte te zetten.
Nomenclatuur
Anorganische en organische nitrieten delen een aanzienlijk eenvoudige nomenclatuur. Om ze te noemen, worden de woorden 'nitrite van', gevolgd door de naam van het metaal en de valentie die tussen haakjes geschreven is, eerst geplaatst. Evenzo kunnen de eindes -co en -so in het geval dat er meer dan één Valencia is gebruikt.
Bijvoorbeeld de CUNO2 Kan op twee manieren worden genoemd: kopernitriet (I) of kopie nitriet.
Deze nomenclatuurregel is ook van toepassing op organische nitrieten. Bijvoorbeeld cho3Ono wordt methilo nitrito genoemd, omdat ch3 komt overeen met groep R gekoppeld aan de no -zuurstof2.
De nomenclatuur kan ingewikkeld worden als er andere groepen van gelijke of grotere chemische relevantie zijn dan het nee2, of als het metaalcomplexen zijn.
Opleiding
Nitrificatie
Veel anorganische nitrieten worden in de natuur gevormd in een van de stappen van de stikstofcyclus: nitrificatie. Dit proces bestaat uit de oxidatie van de ammoniak die wordt uitgevoerd door micro -organismen, met name, door nitrosomonas -bacteriën.
Nitrificatie dekt ook de daaropvolgende oxidatie van nitraat tot nitraat; Nitrietvorming is echter de langzame stap van deze reacties, omdat het een grotere energie vereist en een grotere kinetische barrière moet overwinnen.
De volgende vergelijking is een voorbeeld van de nieuw blootgestelde:
2nh4+ + 3e2 → 2no2- + 4h+ + 2h2OF
Verschillende enzymen nemen deel aan deze reactie en hydroxylamine wordt geproduceerd, NH2Oh, dat is het product waaruit nitrietanionen eindelijk voortkomen.
Het is dankzij de nitrificatie dat planten nitrieten bevatten, en op hun beurt de dieren die ze consumeren. Nitrieten zijn niet alleen aanwezig in de bodem, maar ook in de zeeën, en bijna al hun natuurlijke productie is te wijten aan de oxidatieve en anaërobe werking van verschillende micro -organismen.
Stikstofoxiden in basismedia
De nitrieten van alkalische metalen kunnen industrieel worden bereid door stikstofoxiden te bubbelen in basisoplossingen of media, hetzij van hun respectieve hydroxiden of carbonaten. Natriumnitriet treedt bijvoorbeeld op volgens de volgende reactie:
Nee +nee2 + NaOH → 2nano2 + H2OF
In het geval van ammoniumnitriet wordt dyitrogene trioxide in ammoniak geborreld:
Kan u van dienst zijn: Rodio: Geschiedenis, eigenschappen, structuur, gebruik, risico2nh3 + H2Of +n2OF3 → 2nh4NEE2
Reactie met stikstofmonoxide
Alquilico nitrieten, Rono, kunnen worden gesynthetiseerd door React. De algemene reactie zou de volgende zijn:
R-OH → R-AON
Nitrieten Toepassing
Vleesuitharding
 De roodachtige kleur van het vlees is te wijten aan de remedie met nitraatzouten en nitraat. Bron: Pxhere.
De roodachtige kleur van het vlees is te wijten aan de remedie met nitraatzouten en nitraat. Bron: Pxhere. Nitrieten hebben antibacteriële effecten, dus ze worden in matige hoeveelheden toegevoegd aan vlees om hun rot te vertragen. Naast het vervullen van deze functie, reageren ze met vleeseiwitten om hen een meer roodachtige en aantrekkelijke kleur te verlenen.
De slechte kant van deze praktijk is dat sommige vleeswaren te veel nitrietzouten kunnen hebben, en bij het koken bij hoge temperaturen, transformeren ze in nitrosoaminas. Daarom bestaat er een risico op het vergroten van de kansen om een soort kanker op te lopen als de consumptie van dit gezouten vlees overdreven is.
Staafkleur
Nitrieten worden gebruikt in organische chemie om de diadatiereactie uit te voeren, waarmee de kleur- of kleurstoffen worden gesynthetiseerd.
Pig
Sommige nitrietcomplexen, zoals kobalt, kunnen worden gebruikt als pigmenten voor schilderijen of porselein vanwege hun opvallende kleuringen.
Vaatverwijder
Nitrieten zijn verantwoordelijk voor het genereren van stikstofoxide in het lichaam in gebrekkige zuurstofgebieden. Hij is geen signaalmolecuul, dat reageert op bloedvaten die ontspannen en uitbreiden. Deze uitbreiding of dilatatie heeft als gevolg dat de bloeddruk afneemt.
Voorbeelden van nitrieten
Ten slotte zullen enkele voorbeelden van nitrieten worden vermeld met hun respectieve formules en namen:
-Oudere broer2: natriumnitraat
-Kno2: kaliumnitriet
-Mg (nee2))2: Magnesiumnitriet
-Tuit2))2: calciumnitriet
-Ch3Ch2Ono: ethylnitriet
-NH4NEE2: ammoniumnitriet
-Zn (nee2))2: zinknitriet
-PB (nee2))2: Lood nitriet (II) of plumbose nitriet
-Geloof (nee2))3: IJzernitriet (III) of ijzernitriet
-(Ch3))2Chch2Ch2Ono: Isoamilo Nitrito
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Nitriet. Opgehaald uit: in.Wikipedia.borg
- Elsevier B.V. (2020). Nitriet. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Alfa Aesar. (2020). Nitrietzouten. Themo Fisher Scientific. Hersteld van: Alfa.com
- De redacteuren van Enyclopaedia Britannica. (23 februari 2018). Nitrieten. Encyclopædia Britannica. Hersteld van: Britannica.com
- Anthony R. Butler & Martin Feelisch. (22 april 2018). Therapeutisch gebruik van anorganisch nitriet en nitraat. doen.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10 februari 2020). Zijn nitraten en nitrieten in voedingsmiddelen schadelijk? Hersteld van: Healthline.com
- « Sociale gedragstheorie, typen, normen, voorbeelden
- Binaire verbindingsvorming, typen, voorbeelden, nomenclatuur »

