Binaire verbindingsvorming, typen, voorbeelden, nomenclatuur
- 2555
- 409
- Dewey Powlowski
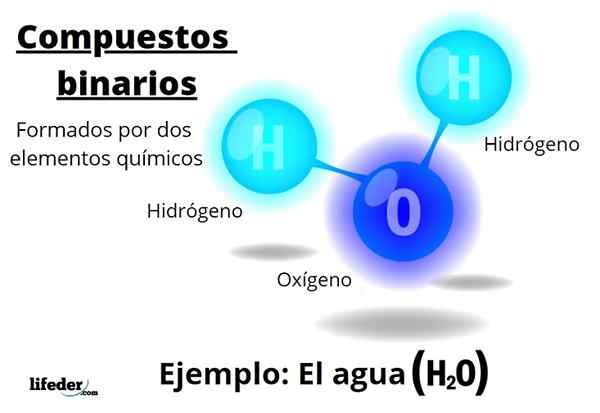
De binaire verbindingen Ze worden allemaal gevormd door twee chemische elementen, ongeacht het aantal van hun atomen of hun interacties. De algemene formule voor deze verbindingen isNBM, waar a en b twee verschillende elementen van het periodiek systeem zijn, en N En M hun respectieve stoichiometrische coëfficiënten.
Bijvoorbeeld water, h2Of het is een binaire verbinding, misschien wel de meest representatieve van hen. Water bestaat uit waterstof, H en zuurstof, of dus twee chemische elementen toevoegen. Merk op dat de stoichiometrische coëfficiënten aangeven dat er twee waterstof en één zuurstofatomen zijn, maar het is nog steeds een binaire verbinding.

Binaire verbindingen kunnen bestaan uit ionen, moleculen, drie -dimensionale netwerken of zelfs neutrale metaalatomen. Het belangrijkste is dat ongeacht de aard van zijn chemische binding of de samenstelling ervan wordt gevormd door twee verschillende chemische elementen. Bijvoorbeeld waterstofgas, h2, Telt niet als binaire compound.
Binaire verbindingen lijken misschien niet, in eerste instantie, zo overvloedig en complex in vergelijking met ternaire of quaternaire verbindingen. Onder hen zijn echter veel essentiële stoffen voor terrestrische ecosystemen, zoals zouten, oxiden, sulfiden en sommige gassen van immense biologische en industriële waarde.
[TOC]
Hoe zijn binaire verbindingen?
Bereidingsmethoden of synthetische routes om binaire verbindingen te vormen, hangt af van de identiteiten van de twee chemische elementen A en B. In principe en in het algemeen moeten beide elementen echter in een reactor worden gecombineerd, zodat ze met elkaar kunnen communiceren. Dus als de omstandigheden gunstig zijn, zal er een chemische reactie plaatsvinden.
Met een chemische reactie, zullen elementen A en B zich aansluiten of koppelen (ionisch of covalent) om de verbinding te vormenNBM. Veel binaire verbindingen kunnen worden gevormd door directe combinatie van hun twee pure elementen, of het volgen van andere meer economisch haalbare alternatieve methoden.
Het kan u van dienst zijn: zinkoxide (ZnO): structuur, eigenschappen, gebruik, risico'sTerugkerend naar het voorbeeld van water, waterstof, h2, en zuurstof, of2, Ze combineren bij hoge temperaturen zodat er een verbrandingsreactie tussen hen is:
2h2(g) + of2(g) → 2H2O (g)
Water daarentegen kan worden verkregen door uitdrogingsreacties van verbindingen zoals alcoholen en suikers.
Een ander voorbeeld van de vorming van een binaire verbinding komt overeen met ferro sulfide, FES:
Geloof (s) + s (s) → fes (s)
Waar deze keer zowel ijzer als zwavel vast zijn als geen frisdrankstoffen. En dit is hetzelfde met verschillende binaire zouten, bijvoorbeeld natriumchloride, NaCl, het combineren van metallisch natrium met chloorgassen:
2na (s) + Cl2(g) → 2Nacl (s)
Nomenclatuur
De namen van alle binaire verbindingen worden meestal beheerst door dezelfde regels.
Voor de verbinding naarNBM, De naam B wordt eerst genoemd in zijn anionische vorm; dat wil zeggen, met het einde -uro. In het geval dat B uit zuurstof bestaat, wordt het echter genoemd als een oxide, peroxide of superoxide zoals toegepast.
De naam van B wordt voorafgegaan door Griekse numerale voorvoegsels (Mono, Di, Tri, Tetra, enz.) volgens de waarde van M.
Ten slotte wordt de naam van element A genoemd. In het geval dat het meer dan één valentie heeft, wordt het aangegeven met Romeinse nummers en tussen haakjes. Of indien voorkeur, kunt u de traditionele nomenclatuur kiezen en de achtervoegsels -OOSO E -ICO gebruiken. Element A wordt soms ook voorafgegaan door Griekse numerale voorvoegsels volgens de waarde van N.
Overweeg de volgende binaire verbindingen samen met hun respectieve namen:
-H2O: waterstofoxide of dihydrogen monoxide (deze achternaam is een oorzaak van plagen)
-FES: ijzersulfide (II) of ferro sulfide
-NaCl: natriumchloride of natriumchloride
Kan u van dienst zijn: olie of benzine -ether: formule, structuur, gebruik-Mgcl2: magnesiumchloride, magnetisch chloride of magnesiumdichloride
Merk op dat er geen 'monosodiumchloride' of 'monohierro sulfide' wordt gezegd.
Types: classificatie van binaire verbindingen
Binaire verbindingen worden geclassificeerd volgens wat er worden gevormd of feiten: ionen, moleculen, metaalatomen of netwerken. Toch is deze classificatie niet volledig overtuigend of definitief, kunnen variëren afhankelijk van de overwogen aanpak.
Ionisch
In ionische binaire verbindingen bestaan a en b uit ionen. Dus voor de verbinding metNBM, B is meestal een anion, b-, Terwijl een kation, naar+. NaCl behoort bijvoorbeeld tot deze classificatie, evenals alle binaire zouten, waarvan de algemene formules beter worden weergegeven als MX, waarbij X een anion is, en een metalen kation.
Dus fluoriden, chloriden, bromuros, jodide., Ze behoren ook tot deze classificatie. Er moet echter worden opgemerkt dat sommigen van hen covalent zijn, dus behorende tot de volgende classificatie.
Covalent
Covalente binaire verbindingen worden gevormd door moleculen. Het water behoort tot deze classificatie, omdat het uit H-O-H-moleculen bestaat. Waterstofchloride, HCl, wordt ook beschouwd als een covalente binaire verbinding, omdat het uit H-CL-moleculen bestaat. Merk op dat de NaCl ionisch is, terwijl de HCl covalent is, beide chloriden zijn.
Metalen of netwerken
Binaire verbindingen omvatten ook de legeringen en vaste stoffen van drie -dimensionale netwerken. Voor hen wordt de denominatie van binaire materialen echter meestal beter gebruikt.
Messing, meer dan een compound, wordt bijvoorbeeld beschouwd als een binair materiaal of legering, omdat het wordt gevormd door koper en zink, cu-zn. Merk op dat het niet is geschreven door geen stoichiometrische coëfficiënten te hebben gedefinieerd.
Evenzo is er siliciumdioxide, SIO2, gevormd door silicium en zuurstof. Hun atomen zijn gekoppeld door een drie -dimensionaal netwerk te definiëren, waar u niet over moleculen of ionen kunt praten. Veel nitriden, fosfon en carbiden, wanneer ze niet ionisch zijn, gaan ook over dit soort netwerken.
Kan u van dienst zijn: fenoxyazijnzuur: synthese, procedure, gebruik, risico'sVoorbeelden van binaire verbindingen
 Water is een voorbeeld van een binaire verbinding
Water is een voorbeeld van een binaire verbinding Het zal worden vermeld om verschillende binaire verbindingen af te maken, vergezeld van hun respectieve namen:
-Libr: lithiumbromide
-Splitsen2: calciumchloride
-Fecl3: ijzerchloride (iii) of ijzerchloride
-NAO: natriumoxide
-Beh2: berylliumhydride
-CO2: kooldioxide
-NH3: Stikstof of ammoniak trihydride
-BBP2: Loodjodide (ii) of leiden diyoduro
-Mg3N2: Magnesium nitruro
-Naar de2OF3: Aluminiumoxide of diuminum trioxide
-NA3V: Natriumfosfuro
-Alf3: Aluminium fluoride
-Racen2: Radiochloride of radiodichloride
-BF3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: wolfraamcarbide of wolframium
Elk van deze voorbeelden kan meer dan één naam tegelijk hebben. Hiervan, de CO2 Het heeft een grote impact op de natuur, zoals het wordt gebruikt door planten in het proces van fotosynthese.
Aan de andere kant, de NH3 Het is een van de stoffen met de meest industriële waarde, noodzakelijk voor de synthese van polymere en organische synthese. En ten slotte is de WC een van de moeilijkste materialen die ooit zijn gemaakt.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Artem Cheprasov. (2020). Wat is een binaire compound? - Definitie en voorbeeld. Studie. Hersteld van: studie.com
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Definitie van binaire verbinding. Hersteld van: Thoughtco.com
- Byju's. (2020). Wat zijn binaire verbindingen? Hersteld van: byjus.com
- Chemteam. (S.F.)). Binaire verbindingen van metalen met vaste kosten. Hersteld van: chemteam.Info
- Wikipedia. (2020). Binaire fase. Opgehaald uit: in.Wikipedia.borg
- « Nitrieten eigenschappen, structuur, nomenclatuur, training
- Reactieflap, typen, toepassingen, voorbeelden »

