Zilvernitraat (Agno3) structuur, eigenschappen, gebruik, toxiciteit

- 1709
- 104
- Dewey Powlowski
Hij zilvernitraat Het is een anorganisch zout waarvan de chemische formule agno is3. Van alle zilveren zouten is het de meest economische en degene die een relatieve stabiliteit tegen zonlicht presenteert, dus het neigt minder te ontleden. Het is de oplosbare en predilect zilverbron in elk onderwijs- of onderzoekslaboratorium.
In het lesgeven worden waterige zilvernitraatoplossingen gebruikt om zilverchloride -neerslagreacties te onderwijzen. Evenzo worden deze oplossingen in contact gebracht met metalen koper om een Rédox -reactie te vinden, waarbij het metalen zilver neerslaat in het midden van de gevormde oplossing van het kopernitraat, Cu (nee3))2.
 Zilvernitraatmonstercontainer. Bron: W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Zilvernitraatmonstercontainer. Bron: W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) In de bovenste afbeelding wordt een fles met zilvernitraat getoond. Het kan worden blootgesteld aan licht zonder snel verduistering van zijn kristallen, product van het uiterlijk van zilveroxide.
In navolging van de alchemistische gewoonten en de antibacteriële eigenschappen van metaalzilver, is zilvernitraat gebruikt om wonden te desinfecteren en te cauteriseren. Voor dit doel worden echter zeer verdunde waterige oplossingen gebruikt, of de vaste vaste gemengd met kaliumnitraat aangebracht door de punt van houten staven.
[TOC]
Zilvernitraatstructuur
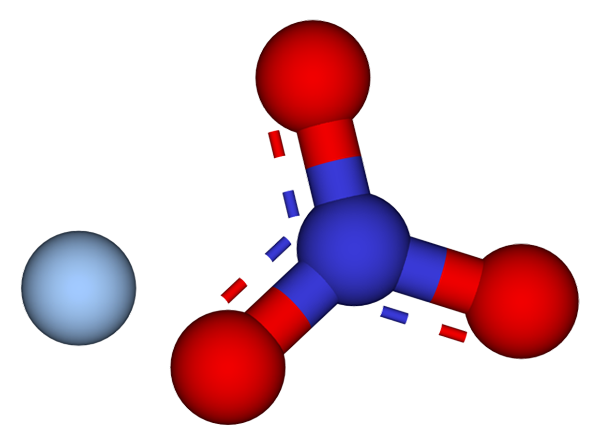 Ionen die de zilveren nitraatkristallen vormen. Bron: CCOIL/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0)
Ionen die de zilveren nitraatkristallen vormen. Bron: CCOIL/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0) In het bovenste beeld worden de Ag -ionen getoond+ en niet3- van zilvernitraat, die worden weergegeven door een model van bollen en bars. De Agno -formule3 geeft het stoichiometrische aandeel van dit zout aan: voor elke kation Ag+ Er is een anion niet3- interactie met hem elektrostatisch.
Het kan u van dienst zijn: zwavel: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikHet anion nee3- (van rode en blauwachtige bollen) heeft een trigonale platte geometrie, waarbij de negatieve belasting wordt gedemoceerd tussen de drie zuurstofatomen. Daarom vinden elektrostatische interacties tussen de twee ionen specifiek plaats tussen de kation Ag+ en een zuurstofatoom van het anion niet3- (Ag+-OF NIET2-)).
Op deze manier, elke Ag+ eindigt met het coördineren of omringen van drie nee3- aangrenzend in hetzelfde vlak of kristallografische laag. De groepering van deze vlakken definieert uiteindelijk een kristal waarvan de structuur ortorrombisch is.
Voorbereiding
Zilvernitraat wordt bereid door een gepolijst metalen zilverstuk aan te vallen met salpeterzuur, koud of heet geconcentreerd:
3 Ag + 4 hno3 (verdund) → 3 Agno3 + 2 H2O +nee
Ag + 2 hno3 (geconcentreerd) → Agno3 + H2O +nee2
Let op de vorming van gassen nee en niet2, die giftig zijn en deze reactie dwingen niet te worden uitgevoerd buiten een extractorbel.
Fysische en chemische eigenschappen
Fysiek uiterlijk
Kleurloos kristallijn vast, toilet, maar zeer bittere smaak.
Molaire massa
169,872 g/mol
Smeltpunt
209.7 ºC
Kookpunt
440 ºC. Bij deze temperatuur lijdt echter een thermische ontleding, waarbij metalen zilver optreedt:
2 Agno3(l) → 2 Ag (s) + o2 (g) + 2 nee2 (G)
Er zijn geen Agno -dampen3, Althans niet in terrestrische omstandigheden.
Oplosbaarheid
De agno3 Het is een ongelooflijk oplosbaar waterbesparing, met een oplosbaarheid van 256 g/ 100 ml bij 25 ° C. Het is ook oplosbaar in andere polaire oplosmiddelen zoals ammoniak, azijnzuur, aceton, ether en glycerol.
Dikte
4.35 g/cm3 bij 24 ºC (omgevingstemperatuur)
Kan u van dienst zijn: gedistilleerd water3,97 g/cm3 bij 210 ºC (net op het smeltpunt)
Stabiliteit
De agno3 Het is een stabiele stof wanneer het correct wordt opgeslagen. Het zal bij elke temperatuur niet ontstoken raken, hoewel het kan worden afgebroken door stikstofoxiden giftige dampen vrij te geven.
Aan de andere kant, hoewel zilvernitraat niet brandbaar is, is het een krachtig oxidatiemiddel dat, wanneer ze in contact komen met organische stof en een warmtebron, een exotherme en explosieve reactie kan veroorzaken.
Daarnaast mag dit zout niet te veel tijd worden blootgesteld aan zonlicht, omdat hun kristallen donker worden vanwege de vorming van zilveroxide.
Silver nitraatgebruik
Neerslag- en analytisch middel
In de vorige sectie werd vermeld van de ongelooflijke oplosbaarheid van de Agno3 In water. Dit houdt in dat ag -ionen+ Ze zullen zonder enig probleem oplossen en zullen beschikbaar zijn om te interageren met een waterig medium -ion, zoals halogenide -anionen (x = f-, Klet-, BR- en ik-)).
Zilver als Ag+, En na de toevoeging van HNO3 Verdunde, neerslachtig de aanwezige fluoriden, chloriden, bromiden en jodiden, die bestaan uit witte of geelachtige vaste stoffen:
Ag+(AC) +X-(AC) → Agx (s)
Deze techniek is zeer terugkerend om halogenuros te verkrijgen en wordt ook gebruikt in tal van kwantitatieve analytische methoden.
Tollens reagens
De agno3 Het speelt ook een analytische rol in de organische chemie, omdat het het belangrijkste reagens is, naast de ammoniak, voor de bereiding van het Tollens -reagens. Dit reagens wordt gebruikt in kwalitatieve proeven die het mogelijk maken om de aanwezigheid van aldehyden en ketonen in een probleemmonster te bepalen.
Synthese
De agno3 Het is een uitstekende oplosbare zilverionenbron. Dit maakt het, naast zijn relatieve en lage kosten, een gevraagd reagens voor talloze organische en anorganische synthese.
Het kan u van dienst zijn: Gibbs Free Energy: eenheden, hoe het wordt berekend, opgeloste oefeningenWat de reactie ook is, als u Ag Iions nodig hebt+, Het is dus vrij waarschijnlijk dat chemicaliën toevlucht nemen tot Agno3.
Geneeskrachtig
De agno3 Hij had veel populariteit in de geneeskunde vóór het uiterlijk van moderne antibiotica. Tegenwoordig wordt het echter nog steeds gebruikt voor specifieke gevallen, omdat het caulster en antibacteriële eigenschappen heeft.
Meestal wordt het gemengd met kno3 Op het puntje van houten staven, zodat het exclusief is gereserveerd voor actueel gebruik. In die zin heeft het gediend voor de behandeling van wratten, wonden, geïnfecteerde nagels, neusmondzweren en bloedingen. Het agno -mengsel3-Kno3 Cauteriza De huid die beschadigd weefsel en bacteriën vernietigt.
De bactericide werking van de agno3 Het is ook gebruikt in waterzuivering.
Toxiciteit en bijwerkingen
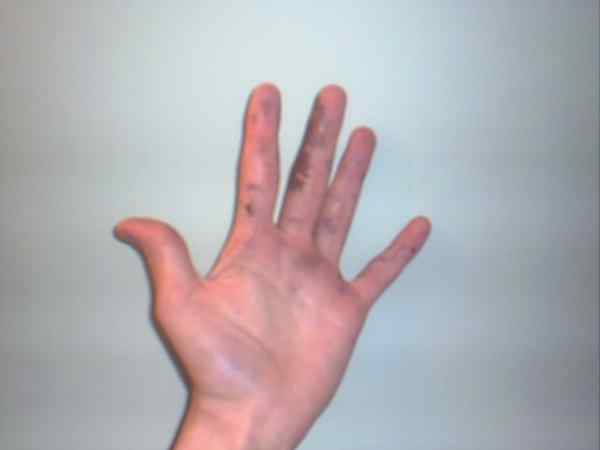 Zilvernitraat kan brandwonden veroorzaken die worden weergegeven door hun paarse of donkere vlekken. Bron: Jane van Baden bij het Engels Wikipedia / Public Domain
Zilvernitraat kan brandwonden veroorzaken die worden weergegeven door hun paarse of donkere vlekken. Bron: Jane van Baden bij het Engels Wikipedia / Public Domain Hoewel zilvernitraat een stabiel salaris is en niet te veel risico's vertegenwoordigt, is het een zeer bijtende vaste stof, waarvan de inname ernstige gastro -intestinale schade kan veroorzaken.
Dat is de reden waarom de manipulatie met handschoenen wordt aanbevolen. Het kan de huid verbranden en in sommige gevallen verduisterd deze totdat het de paarse, toestand of ziekte verandert die bekend staat als Argiria.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Zilvernitraat. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Zilvernitraat. PubChem -database., CID = 24470. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Elsevier B.V. (2020). Zilvernitraat. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Universiteit van Iowa. (2020). Silver nitraatgebruik en toxiciteit. Hersteld van: medicijnen.Uiowa.Edu
- P.F. Lindley & P. Woodward. (1966). Een X-Ray Research of Silver Nitraat: een unieke metaalnitraatstructuur. Journal of the Chemical Society A: anorganisch, fysiek, theoretisch.
- Lucy Bell Young. (2020). Wat zijn het medische gebruik van zilvernitraat. Reagenschemicaliën. Hersteld van: chemicaliën.co.Uk
- « Piperidinestructuur, synthese, derivaten, reacties
- C ++ geschiedenis, kenmerken, gegevenstypen, voorbeelden »

