Bariumnitraat chemische structuur, gebruik, eigenschappen

- 2406
- 138
- Glen Armstrong
Hij bariumnitraat Het is een zout bestaande uit een bariumatoom (BA) en nitraation (nee3)). Het wordt gepresenteerd als een witte kristallijne vaste stof bij kamertemperatuur en bestaat in de natuur als een zeer zeldzaam mineraal dat bekend staat als de Nitrobarita. De eigenschappen maken het een giftige verbinding die zorgvuldig moet worden beheerd.
In feite heeft deze verbinding meerdere toepassingen in de militaire industrie, omdat deze kan worden gekoppeld aan andere chemische stoffen en toegevoegd aan explosieve en brandbroekformuleringen, onder andere.
 Barium nitraat uiterlijk. Bron: W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Barium nitraat uiterlijk. Bron: W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) [TOC]
Formule
Bariumnitraat, ook wel bariumdyitraat genoemd, heeft de chemische formule BA (nee3))2, en wordt meestal geproduceerd via twee methoden.
De eerste hiervan omvat het oplossen van kleine stukjes bariumcarbonaat (Bacchus3) In een medium -autido medium (hno3, een zeer corrosief mineraalzuur), waardoor ijzeronzuiverheden kunnen neerslaan en vervolgens wordt dit mengsel gefilterd, verdampt en gekristalliseerd.
De tweede methode wordt gedaan door de combinatie van bariumchloride (BACL2, een van de bariumzouten met een grotere oplosbaarheid in het water) met een voorverwarmde oplossing van natriumnitraat. Dit genereert een reactie die resulteert in de scheiding van mengbariumnitraatkristallen.
Chemische structuur van bariumnitraat
Dit zout presenteert kenmerken van kubieke kristallijne structuur of watervrij octaedros.
De chemische structuur is als volgt:
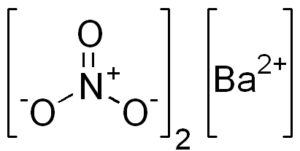
Dissociatie
Bij hoge temperaturen (592 ºC) ontleedt bariumnitraat om bariumoxide (BAO) te vormen, stikstofdioxide (NO2) en zuurstof (of2), Volgens de volgende chemische reactie:
Kan u van dienst zijn: berylhydroxide (be (oh) 2)2BA (nee3))2 + Verwarm → 2bao + 4no2 +OF2
In media met hoge concentraties van stikstofoxide (NO) produceert de ontleding van bariumnitraat een verbinding die bariumnitriet wordt genoemd (BA (NO2))2), Volgens de volgende vergelijking:
Badkamer3))2 + 2NO → BA (nee2))2 + 22
Reacties met oplosbaar metaal of zwavelzuursulfaten (h2SW4) genereer bariumsulfaat (baso4)). De overgrote meerderheid van onoplosbare bariumzouten, zoals carbonaat (Bacchus3), Oxalaat (BAC2OF4) of metaalfosfaat (BA3(PO4)2), worden neergeslagen door vergelijkbare dubbele ontledingsreacties.
Bariumnitraatgebruik
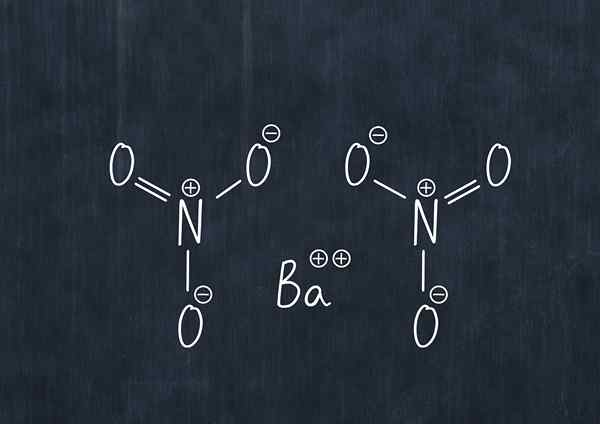 Chemische formule van bariumnitraat
Chemische formule van bariumnitraat Deze stof in stof is een oxidatiemiddel en reageert aanzienlijk bij gemeenschappelijke reductiemiddelen.
Wanneer dit zout wordt gemengd met andere metalen, zoals aluminium of zink in zijn fijn verdeelde vormen, of met legeringen zoals aluminium-magn0esio, schakelt het de impact in en maakt het gebruik van de impact. Om deze reden wordt bariumnitraat beschouwd als een uitstekend onderdeel van militaire wapens en explosieven.
Samen met trinitrotolueen (commercieel bekend als de TNT, of C6H2(NEE2))3Ch3) en een bindmiddel (regelmatig paraffine wax), dit zout vormt een verbinding genaamd baratol, die explosieve eigenschappen heeft. De hoge dichtheid van bariumnitraat zorgt ervoor dat de baratol ook een grotere dichtheid verwerft, waardoor het effectiever is in zijn functie.
Bariumnitraat sluit zich ook aan bij aluminium stof, een formule die resulteert in de vorming van flitsende buskruit, die voornamelijk wordt gebruikt in vuurwerk en theatrale pyrotechniek.
Dit flitsen heeft ook gebruik gezien bij de productie van fakkels (zoals antimile maten van vliegtuigen) en in verbijsterde granaten. Bovendien is deze stof zeer explosief.
Het kan u van dienst zijn: natriumcyanide (NACN): structuur, eigenschappen, risico's, gebruikDit zout wordt gecombineerd met het reactantmengsel genaamd Thermite om een variatie van dit zo -aangedekte beëindiging te vormen, dat korte en zeer krachtige flitsen van hoge temperaturen in kleine gebieden voor een korte tijd genereert.
De beëindiging-TH3 is een bewerking die een samenstelling van 29 % door bariumnitraatgewicht bevat, die helpt het thermische effect te vergroten, vlammen te genereren en de ontstekingstemperatuur van de beëindiging aanzienlijk te verminderen.
Theroots worden meestal gebruikt bij de productie van brandbureaus en hebben de functie van het vernietigen van militaire tankpantser en structuren.
Bovendien was bariumnitraat een van de meest gebruikte ingrediënten bij de productie van brandbevestiging die door de Britten in hun oorlogsvliegtuigen werd gebruikt tijdens de Tweede Wereldoorlog, die bewapend waren met brandsterkte die diende om vijandelijke vliegtuigen te vernietigen.
Ten slotte heeft dit zout gebruik in het productieproces van bariumoxide, in de thermionische klepindustrie en, zoals reeds gezegd, bij het creëren van pyrotechniek, vooral die van groene kleuren.
Fysische en chemische eigenschappen
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Zout wordt gepresenteerd als een witte, hygroscopische en toilet solide, die weinig oplosbaar is in water en volledig onoplosbaar is in alcoholen.
Het heeft een molaire massa van 261,337 g/mol, een dichtheid van 3,24 g/cm3 en een fusiepunt van 592 ºC. Bij het bereiken van zijn kookpunt breekt het af, zoals hierboven is gezegd. Bij kamertemperatuur heeft het de oplosbaarheid van de water van 10,5 g/100 ml.
Het wordt als stabiel beschouwd, maar het is een sterk oxidatiemiddel en moet weg zijn van brandbare materialen om brand te voorkomen. Het heeft watergevoeligheid en mag niet worden gemengd met zuren of watervrij.
Kan u van dienst zijn: adsorptie -isothermen: concept, typen, voorbeeldenIn hoge concentraties (bijvoorbeeld containers) moeten worden geïsoleerd uit stoffen die het kunnen laten reageren, omdat het gewelddadig kan exploiteren.
Net als elke andere oplosbare verbinding van barium, is het een giftige stof voor dieren en mensen.
It should not be inhaled or consumed, since symptoms of poisoning (especially hardening of facial muscles), vomiting, diarrhea, abdominal pain, muscle tremors, anxiety, weakness, respiratory distress, cardiac irregularity and seizures and seizures.
De dood kan optreden na een vergiftiging met deze stof, enkele uren of enkele dagen na het presenteren.
De inhalatie van bariumnitraat genereert irritatie in het ademhalingsslijmvlies en, in beide wijze van vergiftiging, moeten oplossingen van sulfaatzouten worden bereid om eerste hulp toe te passen op de getroffen.
In het geval van morsen moet het worden geïsoleerd uit brandbare stoffen en materialen en in geval van brand moet u nooit in contact komen met droge chemicaliën of schuimen. Het gebied moet worden overspoeld met water als de brand groter is.
Referenties
- Mabus. (S.F.)). Sciencemadness. Verkregen uit Sciencemadness.borg
- Verenigde Staten ininvordering TH3-M50A3. (S.F.)). Verkregen uit munitiepagina's.com
- Cameo chemicaliën. (S.F.)). Verkregen van cameochemicaliën.NOAA.Gov
- Chem. (S.F.)). Verkregen van Chemspider.com
- « SOJ Productieve circuitfasen en -kenmerken
- Dynamiek van voorbeelden van de deeltjessysteem, oefeningen »

