Dipolair moment hoe het wordt berekend en voorbeelden

- 1470
- 3
- Kurt Aufderhar Jr.
Hij Dipolair moment Het is een chemische eigenschap die aangeeft hoe heterogeen de elektrische ladingen worden verdeeld in een molecuul. Het wordt uitgedrukt in Debye -eenheden, 3,33 · 10-30 C · m, en meestal variëren hun waarden van 0 tot 11 d.
Zeer polaire verbindingen hebben meestal grote dipoolmomenten; Terwijl de apolar, kleine dipoolmomenten. Hoe meer gepolariseerd de elektrische ladingen in een molecuul zijn, hoe groter het dipoolmoment; dat wil zeggen, er moet een gebied zijn dat rijk is aan elektronen, Δ- en een andere slechte in elektronen, δ+.
 De Two -Color Draft dient als een analogie met twee polen, positief en negatief, van een molecuul met een duidelijke dipoolmoment. Bron: Pexels.
De Two -Color Draft dient als een analogie met twee polen, positief en negatief, van een molecuul met een duidelijke dipoolmoment. Bron: Pexels. Het dipoolmoment, μ, is een vectorgrootte, dus wordt het beïnvloed door de hoeken van de banden en in het algemeen door de moleculaire structuur.
Wanneer het molecuul lineair is, kan het worden vergeleken met een twee -gekleurd ontwerp. Zijn negatieve einde Δ-, het zou overeenkomen met de rode kleur; Terwijl het positieve, Δ+, de blauwe kleur zou zijn. Naarmate de magnitudes van negatieve belastingen toenemen in de Δ-pool en de afstand die het scheidt van δ+, neemt het dipoolmoment toe.
Chemisch gezien betekent het bovenstaande dat hoe groter het verschil in elektronegativiteit tussen twee atomen, en hoe langer de afstand die hen scheidt, hoe groter het dipoolmoment tussen hen.
[TOC]
Hoe wordt het dipoolmoment berekend??
Het wordt beschouwd als een covalent verband tussen twee atomen, A en B:
A-B
De afstand tussen positieve en negatieve gedeeltelijke belastingen wordt al gedefinieerd door de lengte van de link:
NAARδ+-Bδ-
Omdat protonen en elektronen dezelfde grootte van elektrische lading hebben, maar met tegengestelde borden, 1.6 · 10-19C, hier is rekening gehouden met het evalueren van het dipoolmoment tussen A en B door de volgende vergelijking:
Het kan u van dienst zijn: verschillen tussen organische en anorganische verbindingenμ = Δ ·D
Waarbij μ het dipoolmoment is, is δ de belasting van het elektron zonder het negatieve teken, en D De lengte van de link die in meters wordt uitgedrukt. Bijvoorbeeld, ervan uitgaande D Het heeft een waarde van 2 A (1 · 10-10m) Het dipoolmoment, μA-B zal zijn:
μA-B = (1.6 · 10-19C) · (2 · 10-10M)
= 3.2 · 10-29Cm
Maar omdat deze waarde erg klein is, wordt de Deby -eenheid gebruikt:
μ = (3,2 · 10-29C · m) · (1 D/3.33 · 10-30 Cm)
= 9,60 d
Deze μA-B-waarde kan aannemen dat de A-B-link meer ionisch is dan covalent.
Voorbeelden
Water
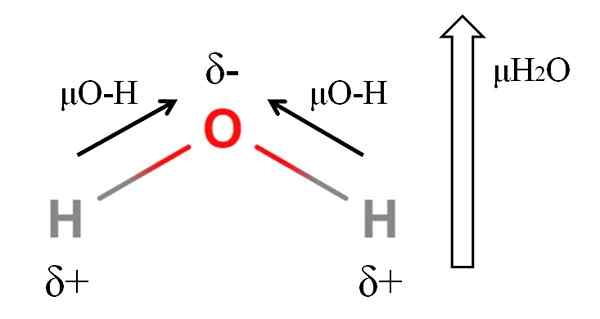 Dipoar moment van een watermolecuul. Bron: Gabriel Bolívar.
Dipoar moment van een watermolecuul. Bron: Gabriel Bolívar. Om het dipoolmoment van een molecuul te berekenen, moet u alle dipoolmomenten van hun respectieve links toevoegen, rekening houdend met de hoeken van links en een beetje trigonometrie. Dit eerst.
Water heeft een van de grootste dipoolmomenten die kunnen worden verwacht voor een covalent compound. In het bovenste beeld hebben we dat waterstofatomen positieve gedeeltelijke belastingen hebben, Δ+, terwijl de zuurstof de negatieve gedeeltelijke belasting draagt, δ-. De O-H-link is vrij polair (1.5d), en er zijn er twee in een H -molecuul2OF.
Over het algemeen wordt een vector getrokken van het minder elektronegatieve atoom (H) tot de meest elektronegatieve (O). Hoewel ze niet worden getrokken, zijn er op het zuurstofatoom twee paar niet gedeelde elektronen, die het negatieve gebied nog meer "concentreren".
Vanwege de hoekige geometrie van h2Of, de dipoolmomenten doen zich aan in de richting van het zuurstofatoom. Merk op dat de som van de twee μO-H 3D zou geven (1.5+1.5); Maar zo is het niet. Het dipoolmoment van water heeft een experimentele waarde van 1.85d. Hier is het effect van de dichte hoek van 105º tussen de H-O-H-links.
Het kan u van dienst zijn: Laboratoriumthermometer: kenmerken, waarvoor is het, gebruik, voorbeeldenMethanol
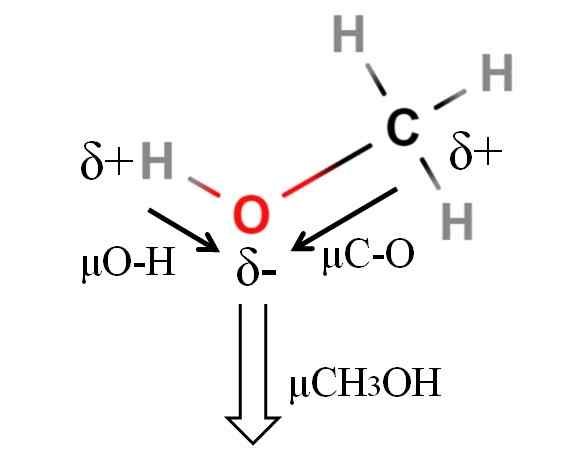 Dipoar moment van een methanolmolecuul. Bron: Gabriel Bolívar.
Dipoar moment van een methanolmolecuul. Bron: Gabriel Bolívar. Het dipoolmoment van methanol is 1.69d. Is minder dan water. Daarom hebben atomaire massa's niet te veel invloed op het dipoolmoment; Maar zijn atomaire radio's. In het geval van methanol kunnen we niet bevestigen dat uw H-O-link een μ gelijk is aan 1.5 D; Sindsdien zijn moleculaire omgevingen verschillend in Cho3Oh en h2OF.
Daarom zouden we de lengte van de H-O-link in de methanol moeten meten om μO-H te kunnen berekenen. Wat kan worden bevestigd, is dat μO-H groter is dan μC-O.
Methanol wordt gecatalogiseerd als een van de meest polaire oplosmiddelen die samen met water en ammoniak kunnen worden gevonden.
Ammoniak
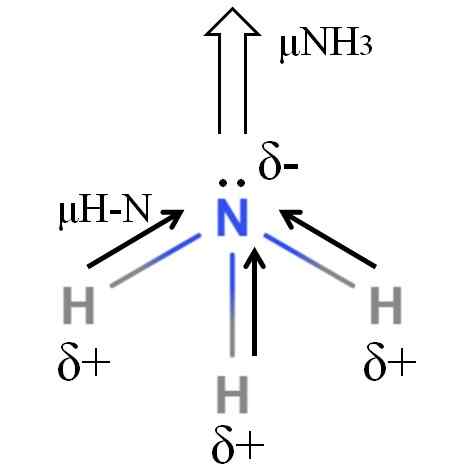 Dipoar moment van een ammoniakmolecuul. Bron: Gabriel Bolívar.
Dipoar moment van een ammoniakmolecuul. Bron: Gabriel Bolívar. H-N-bindingen zijn vrij polair, dus stikstof na zijn grotere elektronegativiteit trekt elektronen naar zichzelf aan (superieure afbeelding). Daarnaast hebben we bij hem een paar niet -gepacteerde elektronen, die hun negatieve belastingen bijdragen aan het δ -gebied-. Daarom overheersen elektrische ladingen in het ammoniakstikstofatoom.
De ammoniak heeft een dipoolmoment van 1.42d, minder dan die van methanol. Als zowel de ammoniak als de methanol in concepten kunnen worden omgezet, zou blijken dat het ontwerp van de methanol meer gedefinieerde polen heeft in vergelijking met de versie van de ammoniak.
Ethanol
In het geval van ethanol, cho3Ch2Oh je dipoolmoment is heel dicht bij die van methanol, maar het heeft de neiging om lagere waarden te hebben. Met meer koolstofatomen die het A+-gebied vormen, begint het zuurstofatoom dat A- vertegenwoordigt, een beetje van zijn "relatieve negatieve intensiteit" verliezen.
Kan u van dienst zijn: dimethylamine ((CH3) 2NH): structuur, eigenschappen, gebruik, risico'sKooldioxide
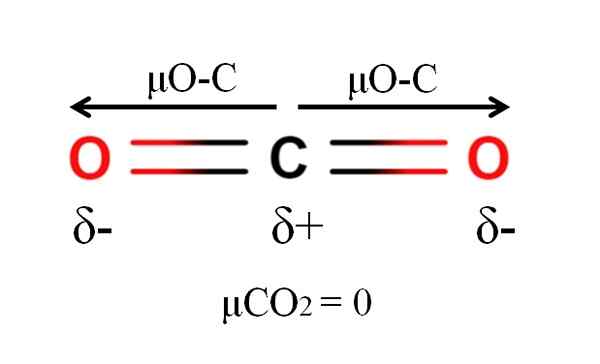 Dipoar moment van een kooldioxidemolecuul. Bron: Gabriel Bolívar.
Dipoar moment van een kooldioxidemolecuul. Bron: Gabriel Bolívar. Koolstofdioxide heeft twee polaire bindingen, C = O, met hun respectieve dipoolmomenten μO-c. Zoals echter te zien is in het superieure beeld, de lineaire geometrie van de CO2 laat de twee μO-C elkaar vectoriaal annuleren, zelfs als de koolstof een positieve gedeeltelijke belasting heeft en de zuurstof negatieve gedeeltelijke belastingen.
Om deze reden is koolstofdioxide een apolair molecuul, omdat μco2 heeft een waarde van 0D.
Methaan
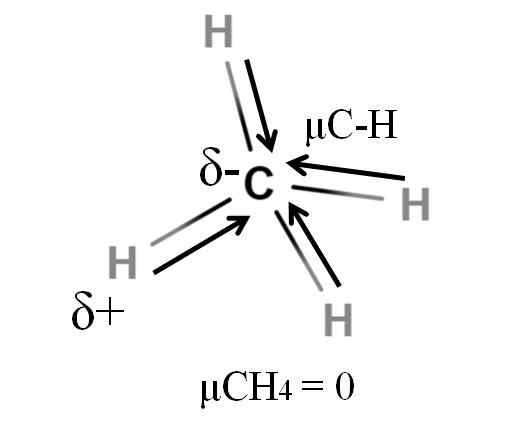 Dipolair moment voor een methaanmolecuul. Bron: Gabriel Bolívar.
Dipolair moment voor een methaanmolecuul. Bron: Gabriel Bolívar. Zowel methaan als koolstofdioxide delen iets gemeen: het zijn zeer symmetrische moleculen. Over het algemeen, hoe symmetrischer een molecuul, hoe minder het dipoolmoment zal zijn.
Als we het molecuul van Cho zien4, De C-H-bindingen zijn polair en de elektronen zijn gericht op het koolstofatoom omdat ze iets meer elektronegatief zijn. Men zou kunnen worden gedacht dat koolstof een zeer negatief A -gebied zou moeten zijn; als een concept met zijn intense rode centrum en zijn blauwachtige eindigen.
Wanneer de Cho echter is verdeeld4 In twee zouden we twee H-C-H-helften verkrijgen, één aan de linkerkant en de andere rechts, vergelijkbaar met de molecuul h2OF. Het dipoolmoment als gevolg van het toevoegen van deze twee μC-H wordt dus geannuleerd met dat van de andere helft. En daarom μch4 heeft een waarde van 0D.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Walter J. Moore. (1963). Fysische chemie. In chemische kinetiek. Vierde editie, Longmans.
- Iran. Levine. (2009). Principes van fysicochemie. Zesde editie, pagina 479-540. MC Graw Hill.
- Helmestine, Anne Marie, pH.D. (29 januari 2020). Dipool Moment Definitie. Hersteld van: Thoughtco.com
- Blaber Mike. (29 september 2019). Dipoolmomenten. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Larita Williams. (2020). Dipoolmoment: definitie, vergelijking en voorbeeld. Studie. Hersteld van: studie.com
- Wikipedia. (2020). Bond dipoolmoment. Opgehaald uit: in.Wikipedia.borg
- « Gaslighting hoe het te detecteren en 5 tips om het te vermijden
- Onomatopee -kenmerken, functie, typen, voorbeelden »

