Molariteitsconcentratie, eenheden, berekening, oefeningen
- 2348
- 534
- Dewey Powlowski
De Molariteit Het is de concentratie van een oplossing die in mol wordt uitgedrukt uit de opgeloste oplossing. Het wordt afgekort als M en drukt een relatie uit tussen de massa van de opgeloste stof en het volume van de oplossing (m/v); Hoewel deze relatie op een traditionele manier wordt uitgedrukt als volumewicht.
Eén mol is het aantal atomen of moleculen in het atoom- of molecuulgewicht; Het wordt uitgedrukt in gram/mol. Eén mol is gelijk aan 6.02 · 1023 atomen of moleculen, bekend als het Avogadro -nummer.
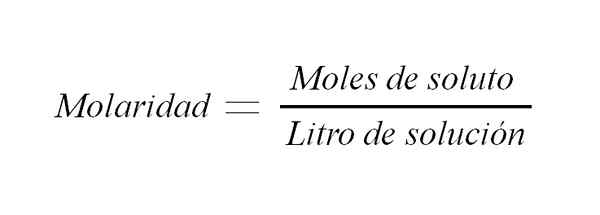 Molariteitsformule. Bron: Gabriel Bolívar.
Molariteitsformule. Bron: Gabriel Bolívar. Er zijn andere manieren om de relatie uit te drukken tussen de massa van een opgeloste stof en het volume, waaronder: het procentuele relatie tussen de massa van de opgeloste stof en het volume van de oplossing, en normaliteit. De laatste wordt uitgedrukt als het aantal equivalenten van een opgeloste oplossing.
Ondertussen drukt de molealiteit, die wordt gedefinieerd als het aantal mol mol per kilogram oplosmiddel, meestal water, een relatie uit tussen de massa van de opgeloste stof en de massa van het oplosmiddel (m/m).
De vorm van expressie van de concentratie van een oplossing in delen per miljoen (PPM) drukt een relatie uit tussen een deel van de opgeloste stof en een miljoen delen van de oplossing, meestal gebruikt om een massa-MASA-verhouding (M/M) uit te drukken. Maar u kunt een massa-volumeverhouding uitdrukken (M/V).
Molaire concentratie kan, naast het tot expressie brengen van zichzelf in mol per liter, worden uitgedrukt als millimolen/liter (millimolaire oplossing); Micromoles/ liter (micromolaire oplossing); enz.
Molariteitsproblemen kunnen worden opgelost met behulp van een analytische methode en door het gebruik van "de regel van drie". De keuze van een methode hangt af van het vermogen om een van de methoden te gebruiken.
[TOC]
Molaire concentratie
Wordt gebruikt om de concentratie van een opgeloste oplossing uit te drukken in een bepaalde oplossing van oplossing.
M = N/V (1)
Waarbij m gelijk is aan molariteit, is n het aantal mol en v het volume van de oplossing. Dus de molariteit van een oplossing is het aantal mol opgeloste stof per volume van oplossing die in liters wordt uitgedrukt.
Aan de andere kant is het aantal mol
n = m / pm (2)
Zijnde m de massa van de opgeloste opgeloste stof en pm zijn molaire massa.
Kan u van dienst zijn: aldehydosVervangen (2) in (1):
M = (M / PM) / V
Eenheden
De eenheid in het internationale systeem voor molaire concentratie is mol/m3. Dit komt overeen met een millimolaire oplossing, omdat een m3 gelijk aan 1.000 liter. In de takken van chemie en biologie wordt molaire concentratie meestal uitgedrukt als mol/l. Deze eenheid wordt uitgedrukt met de M (kapitaal).
Een oplossing van één mol/L, is gelijk aan een M; Een 10 -oplossing-3 mol/l, gelijkwaardig aan 1 mm (millimolair); en een 10 -oplossing-6 mol/l, gelijkwaardig aan 1 µm (micromolair).
Hoe molariteit te berekenen?
Het is handig om de hierboven aangegeven uitdrukkingen te gebruiken, omdat dit ervoor zorgt dat het resultaat van het toepassen van de formule in mol/liters zal geven, wat de definitie is van molaire concentratie.
Dus om de molariteit van een oplossing te berekenen, is het noodzakelijk om de concentratie van de opgeloste stof in g / l uit te drukken. Ontdek vervolgens het molecuulgewicht van de opgeloste stof (g / mol) en vind het quotiënt tussen concentratie en molecuulgewicht. Het verkregen resultaat is de molariteit die wordt uitgedrukt in mol / liter.
Overstappen van molariteit naar molealiteit
Een noodzakelijk feit om van molariteit naar molealiteit te gaan, is om de dichtheid van de oplossing te kennen. Dit maakt het mogelijk om de massa van de oplossing te kennen, een essentiële vereiste voor de berekening van de moleliteit.
Eerste stap
Eerst moet je van molaire concentratie naar gram/liters gaan. Om dit te doen, is het voldoende om de molariteit van de oplossing te vermenigvuldigen met het molecuulgewicht van de opgeloste stof.
Gram/liter van de opgeloste stof = molariteit (mol/liter) · molecuulgewicht van de opgeloste stof (gram/mol).
Hierdoor kunt u de massa van de opgeloste oplossing verkrijgen in 1 L oplossing.
Tweede stap
Dan is het noodzakelijk om de massa van de oplossing te berekenen. Om dit te doen, wordt de dichtheid van hetzelfde gebruikt. Meestal wordt de dichtheid uitgedrukt in gram/kubieke centimeter of milliliter.
Oplossing Mass (G) = Oplossing Volume (ml) · Dichtheid (g/ml)
Derde stap
Het verkrijgen van de oplosmiddelmassa. Omdat de massa van de oplossing gelijk is aan de massa van de opgeloste stof plus de massa van het oplosmiddel, is om de massa van de laatste te verkrijgen voldoende om de massa van de oplossing af te trekken (stap 2) de massa van de opgeloste stof (stap 1).
Het kan u van dienst zijn: perchlooroxide (CL2O7)Vierde stap
Ten slotte moet u de massa van de opgeloste stof (g) van de oplossing doorgeven aan de massa opgeloste stof die overeenkomt met 1.000 g of 1 kg oplosmiddel. Om dit te doen, zou het voldoende zijn om een regel te maken van drie eenvoudige of andere equivalente wiskundige bewerking.
Vijfde stap
Verdeel G van opgeloste stof/1000 g oplosmiddel tussen het molecuulgewicht van de opgeloste stof (g/mol) om de moraliteit van de oplossing te verkrijgen.
Numeriek voorbeeld
Een glucose -oplossing van 3 m (180 g/mol molecuulgewicht) heeft een dichtheid van 1,15 g/ml. Bereken de molealiteit van deze oplossing.
We berekenen eerst de gram van glucose opgelost in een liter oplossing:
g/l = 3 mol/l · 180 g/mol
= 540 g/l
Vervolgens berekenen we de massa van de oplossing uit de dichtheid:
g van de oplossing (massa) = 1.000 ml · 1,15 g/ml
= 1.150 g
De oplosmiddelmassa wordt gegeven door verschil:
Oplosmiddelmassa = oplossingsmassa - opgeloste massa
= 1.150 g - 540 g
= 610 g
Maar 610 g zijn niet 1000 g oplosmiddel als het bepalen van de definitie van molealiteit. Daarom moet hoeveel gram glucose worden berekend opgelost in 1000 g oplosmiddel:
Opgeloste massa = 540 g SOLUTE · (1.000 g oplosmiddel / 610 g oplosmiddel)
= 885.25 g
En ten slotte wordt de molealiteit berekend door de gram terug te brengen naar mollen:
Molaliteit = (885,25 g opgeloste stof / 180 g / mol)
= 4,92 mol opgeloste stof / kg oplosmiddel
= 4,92 m
Problemen opgelost
Probleem 1
Hoeveel cupric sulfaat zal nodig zijn om 500 ml van een 0,4 M oplossing te bereiden? Druk het resultaat uit in grams. Molecuulgewicht van cupric sulfaat (CUSO4): 160 g/mol.
We bepalen eerst de mol die in een dergelijke oplossing moet worden opgelost:
M = N/ V
n = m · v
n = (0,4 mol/l) · 0,5 l
= 0,2 mol
Wetende dan het aantal mol cupric sulfaat kan worden verkregen zijn massa
N = m/pm
M = N · Molecuulgewicht
M = 0,2 mol · 160 g/mol
= 32 g CUSO4
Dat wil zeggen, 32 gram van dit zout moet worden opgelost in 500 ml oplosmiddel.
Probleem 2
Welk volume van een oplossing is nodig om 0,4 mol opgeloste stof op te lossen, het heeft een concentratie van 0,25 m?
Het volume van de oplossing wordt verkregen uit het concept van molariteit
Kan u van dienst zijn: Samario: kenmerken, structuur, verkrijgen, gebruikM = N / V
V = n / m
V = 0,4 mol / (0,25 mol / l)
= 1,6 l
Het betekent dat de oplossing een volume van 1,6 liter moet hebben om een dergelijke concentratie van 0,25 m te verkrijgen.
Probleem 3
Een massa van 8 g natriumhydroxide (NaOH) wordt opgelost in 60 g oplossing met een dichtheid van 1,6 g/ml. Wat zal de molariteit van de oplossing zijn? Molecuulgewicht van natriumhydroxide: 40 g/mol.
Naoh's mol moet eerst worden berekend:
N = m / pm
= 8 g natriumhydroxide / (40 g / mol)
= 0,2 mol
Nu wordt het volume van de oplossing berekend:
M = V · D
V = 60 g /(1.6 g /ml)
V = 37,5 ml
Om molariteit te verkrijgen, moet het volume van de oplossing in liters worden geplaatst:
V = 37,5 ml · 10-3 L / ml
= 0,0375 l
M = 0,2 mol / 0,0375 l
5.33 mol / l
5.33 m
Probleem 4
Bereken de molariteit van een oplossing van zoutzuur (HCl) met een dichtheid van 1,25 g/ml en een concentratie van 35%, tot expressie. Molecuulgewicht van zoutzuur: 36,5 g/mol.
De massa van 35% zoutzuur wordt bepaald
M = V · D
M = 1.000 ml · 1,25 g/ml
= 1.250 g
Maar niet alles is HCl, maar er is ook water:
HCl -massa = 1.250 g · (35 /100)
= 437,5 g
Dat is hetzelfde als zeggen dat er in een liter van 35% HCL -oplossing 437,5 gram HCl zijn.
Vervolgens worden HCl -mol berekend om vervolgens de molariteit te bepalen:
N = m / pm
n = (437,5 g/l)/(36,5 g/mol)
= 11,98 mol/l
Molariteit = 11,98 m
Probleem 5
Bereken de molariteit van een oplossing die 5 g NaCl bevat in 2 L oplossing. Molecuulgewicht van natriumchloride: 58,5 g/mol.
Mol/L NaCl kan in een enkele stap worden verkregen:
Molariteit = (5 g NaCl / 2 L -oplossing) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol /l
Molariteit = 0,043 m
Een andere procedure zou kunnen zijn:
G / L van NaCl = 5 g / 2 l
= 2,5 g / l
mol / l = (2,5 g / l) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 m
Referenties
- Rodríguez, m. (2007). Scheikunde. Salesiana Editorial Foundation
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2019). Molariteit. Hersteld van: is.Wikipedia.borg
- Atarés Huerta. (S.F.)). Molariteit en molaaliteit. [PDF]. Hersteld van: riunet.UPV.is
- Softchools. (2019). Molariteitsformule. Hersteld van: softschools.com
- « Speciale verbindingskenmerken, training, gebruik
- Moeilijkheden om een natieproject te consolideren »

