Molaliteit

- 721
- 26
- James Dach
Wat is molealiteit?
De Molaliteit, aangeduid met de letter M in kleine letters, is het een term die wordt gebruikt om de concentratie van een oplossing te beschrijven. Het kan worden gedefinieerd als het aantal mol van een opgeloste opgeloste opgeloste in 1 kilogram oplosmiddel.
Het is gelijk aan de mol opgeloste stof (de stof die oplost) gedeeld door de oplosmiddelkilogrammen (de stof die wordt gebruikt om op te lossen).

Waar opgeloste mollen worden gegeven door de vergelijking:
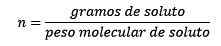
Dus uiteindelijk blijft de molity -vergelijking bestaan
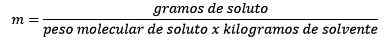
Karakteristieken van molaliteit
- Molaliteit is een maat voor de concentratie van een opgeloste stof in een oplossing. Wordt voornamelijk gebruikt wanneer temperatuur een zorg is.
- Molaliteit is niet zo gebruikelijk als zijn tegenhanger, molariteit (mol opgeloste stof voor elke liter oplosmiddel), maar wordt gebruikt in zeer specifieke berekeningen, vooral met betrekking tot de coligatieve eigenschappen (verhoging van het kookpunt, depressie van het bevriezingspunt). Omdat het volume onderhevig is aan variatie als gevolg van temperatuur en druk, varieert de molariteit ook afhankelijk van temperatuur en druk.
- In sommige gevallen is het gebruik van gewicht een voordeel omdat de massa niet varieert met omgevingscondities.
- Het is belangrijk dat de oplosmiddelmassa en niet de massa van de oplossing worden gebruikt.
- De oplossingen gemarkeerd met morele concentratie worden aangegeven met een kleine letters m. Een oplossing van 1,0 m bevat 1 mol opgeloste stof per kilogram oplosmiddel.
- De voorbereiding van een bepaalde moraliteitsoplossing is eenvoudig omdat het alleen een goede schaal vereist. Zowel het oplosmiddel als de opgeloste stof worden gemengd, in plaats van te worden gemeten door volume.
Het kan u van dienst zijn: propaanzuur- De SI -eenheid (internationaal systeem) voor moliteit is mol/kg, of mol opgeloste stof per kg oplosmiddel. Een oplossing met een mooliteit van 1 mol/kg wordt vaak beschreven als "1 mol" of "1 m".
In navolging van het SI -eenhedensysteem, is het National Institute of Standards and Technology, dat de autoriteit is van de Verenigde Staten over meting, van mening dat de term "moraal" en het "M" -unit Symbool verouderd zijn en suggereert het gebruik van mol/kg.
Verschillen en overeenkomsten tussen molealiteit (M) en molariteit (M)
De bereiding van een oplossing van een bepaalde moraliteit impliceert het wegen van zowel de opgeloste stof als het oplosmiddel en het verkrijgen van zijn massa.
Maar in het geval van molariteit wordt het volume van de oplossing gemeten, waardoor ruimte voor dichtheidsvariaties wordt als gevolg van de conditie van de omgevings- en drukconditie.
Dit betekent dat het voordeelbare druk is, terwijl het deeg ongewijzigd blijft.
Bovendien vinden chemische reacties plaats in massaverhouding en niet volume. Om op het deeg te vertrouwen, kan molealiteit gemakkelijk een massaverhouding of een massafractie worden.
Voor waterige oplossingen (oplossingen waarin water oplosmiddel is) in de buurt van omgevingstemperatuur, is het verschil tussen morele en molaire oplossingen verachtelijk.
Dit komt omdat rond omgevingstemperatuur water een dichtheid van 1 kg / l heeft. Dit betekent dat het "door L" van molariteit gelijk is aan de "door kg" van molealiteit.
Het kan u van dienst zijn: calcium caseinate: structuur, eigenschappen, verkrijgen en gebruikenVoor een oplosmiddel zoals ethanol, waar de dichtheid 0,789 kg / l is, zou een oplossing van 1 m 0,789 m zijn.
Het belangrijke deel van het onthouden van het verschil is:
Molariteit - m → molen per liter oplossing.
Molaliteit - m → mol per kilogram oplosmiddel.
Voorbeelden van molaliteit
voorbeeld 1
Probleem: Wat is de moraliteit van een oplossing die 0 bevat.086 mol NaCl opgelost in 25,0 g water?
Antwoord: In dit voorbeeld wordt de directe morele vergelijking gebruikt:
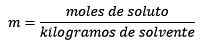
Mol opgeloste stof (NaCl) = 0,086 mol
Massa (water) = 25,0 g = 25,0 x 10-3 kg
U vervangen:
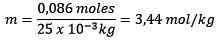
Voorbeeld 2
Probleem: Wat is de moraliteit van een oplossing als 124,2 gram naoh oplost in 1,00 liter water? (Waterdichtheid is gelijk aan 1,00 g/ml).
Antwoord: Water staat bekend als het universele oplosmiddel en de dichtheid wordt meestal ongeveer 1,00 gram per milliliter gegeven, of wat hetzelfde is, 1 kilogram per liter. Dit vergemakkelijkt de conversie van liters naar kilogrammen.
In dit probleem zal de 124,2 gram NaOH moeten worden omgezet in mol (voor mol opgeloste stof) en een liter water zal moeten worden omgezet in kilogrammen (door kilogram oplosmiddel) met behulp van de dichtheid.
Ten eerste is er de molaire massa van NaOH:
P.MNA= 22,99 g/mol
P.MOF= 16 g/mol
P.MH= 1 g/mol
P.MNao= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Ten tweede converteren de grammen van NaOH in mollen, met behulp van het molaire deeg:
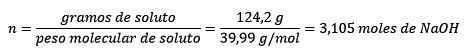
Ten derde wordt de liter water kilogram met behulp van dichtheid:
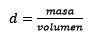
Het deeg vrijmaken, blijft:
Kan u van dienst zijn: goudoxide (iii) (au2o3): wat is, structuur, eigenschappen, gebruik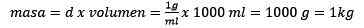
Ten slotte wordt de Molelism -vergelijking opgelost:
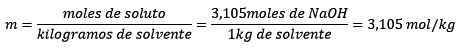
Voorbeeld 3
Probleem: Wat is de watermassa van een waterige oplossing die 0,52 gram bariumchloride bevat (BACL2, PM = 208,23 g/mol) waarvan de concentratie 0,005 mol/kg is?
Antwoord: In dit geval wordt de morele concentratie gebruikt om de hoeveelheid water in oplossing te bepalen.
Ten eerste wordt het aantal mol BACL verkregen2 In de oplossing:
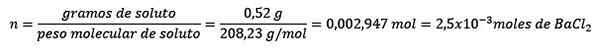
Ten tweede wordt de kilogram oplosmiddel verwijderd van de Molelism -vergelijking en opgelost.
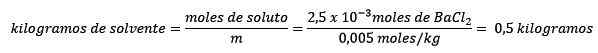
Referenties
- Berekening van het voorbeeld van de molaliteit. Hersteld van Sciententes.borg.
- Wat is een voorbeeld van molaliteit? Hersteld van Socratic.borg.
- (S.F.)). Moraliteit. Hersteld van grenzeloze.com.

