Corpusculair model van materie
- 717
- 34
- Ernesto McKenzie
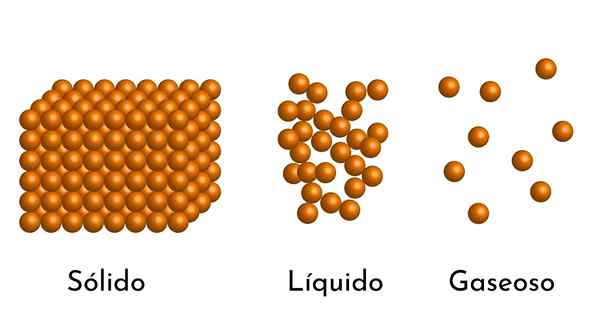
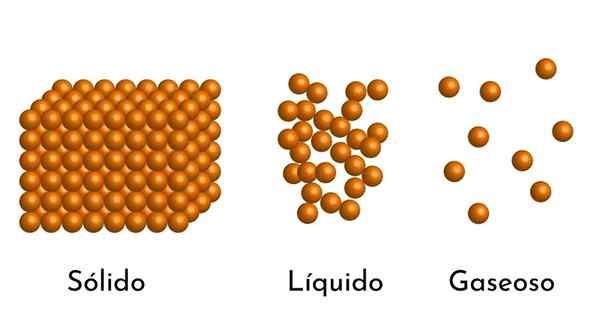 De bekendste staten van de zaak hebben hun uitleg in het corpusculaire model van de zaak
De bekendste staten van de zaak hebben hun uitleg in het corpusculaire model van de zaak Wat is het corpusculaire model van materie?
Hij Corpusculair model van materie Het is een model van de microscopische structuur van materie, die de eigenschappen en het gedrag in elke aggregatiestatus wil verklaren.
Het fundamentele postulaat van het model is dat materie bestaat uit kleine deeltjes, die atomen, ionen of moleculen kunnen zijn, altijd in continue agitatie.
In dit model zijn de wetten van de klassieke mechanica voor deeltjes van toepassing, hoewel ze door het grote aantal aanwezigen niet individueel worden bestudeerd, maar door een statistische behandeling. Op deze manier worden de gemiddelde waarden van de macroscopische interessante grootte, zoals druk, temperatuur en volume verkregen.
Het corpusculaire model verklaart ook eigenschappen zoals viscositeit, hardheid, flexibiliteit en dichtheid van materialen, evenals thermische verwijding, naast andere fenomenen.
Oorsprong van het corpusculaire model van materie
De ideeën over de corpusculaire aard van de materie datum ten minste de 5e eeuw.C. In het oude Griekenland, Leucipo (450 a. C. - 370 a. C.) en Democritus (460 tot 370 tot C), de discipel daarvan, hadden gespeculeerd over de organisatie van materie op microscopisch niveau.
Deze filosofen stelden voor dat materie bestaat uit kleine ondeelbare deeltjes, benoemd atomen, Een woord van Griekse wortel die precies "ondeelbaar" betekent.
De theorie werd uitgesloten door Aristoteles, de meest invloedrijke wijze van zijn tijd. Het was echter pas in de zeventiende eeuw dat corpusculaire theorie opnieuw begon te zijn, en in de 19e eeuw begonnen de geheimen van materie uiteindelijk te onthullen.
In 1803 stelde de Engelse chemicus John Dalton (1766-1844) opnieuw voor dat de zaak werd gevormd door lorpjes die atomen werden genoemd, die in bepaalde verhoudingen gecombineerd werden om de moleculen van een stof te vormen.
Dalton's atomen waren ondeelbaar, maar al snel werd een solide theoretische structuur ontwikkeld, vooral dankzij James C. Maxwell (1831-1979) en Ludwig Boltzmann (1844-1906). Dit vestigde de basis van statistische mechanica en de fysica van de vaste toestand.
Het kan u van dienst zijn: gemiddelde snelheid: formules, hoe het wordt berekend en opgelostFundamentals van het corpusculaire model van materie
De belangrijkste postulaten van het model zijn:
- Materie, ongeacht hun status van aggregatie, wordt gevormd door microscopische deeltjes, die individuele of combinatie -atomen kunnen zijn, om moleculen te vormen.
- De verschillende stoffen verschillen van elkaar omdat ze worden gevormd door verschillende deeltjes.
- Volgens de staat van aggregatie van materie zijn er lege ruimtes tussen de deeltjes, groter in de gassen en kleiner in vaste stoffen.
- De deeltjes die de zaak vormen, zijn in voortdurende agitatie. Tot grotere agitatie, grotere kinetische energie die ze hebben, en als warmte wordt toegevoegd, wordt de beweging van de deeltjes verhoogd.
- In vloeistoffen en vaste stoffen ervaren de deeltjes ook aantrekkingskracht van verschillende intensiteit, vanwege intermoleculaire krachten. In gassen zijn de moleculen zeer gescheiden en bewegen ze snel, dus deze krachten hebben geen grotere incidentie. Maar in vloeistoffen, waarvan de deeltjes meer samenhang hebben, zijn deze krachten intenser, en in vaste stoffen is het nog groter.
Kinetische gassentheorie
Het corpusculaire model werd eerst toegepast op gassen, omdat het de eenvoudigste staat van aggregatie en cohesiekrachten tussen de moleculen is, zijn minimaal. Bovendien waren de eigenschappen van de gassen bekend door de experimentele werken van de Engelse chemicus Robert Boyle en de Franse Joseph Gay Lussac en Jacques Charles.
Het ideale gassenmodel, het eenvoudigste, overweegt dat:
- De grootte van de deeltjes is veel kleiner dan de afstanden daartussen, en dat de afmetingen van de container. Ze zijn specifieke massa's, dat wil zeggen zonder afmetingen en bezet geen volume.
- De deeltjes zijn in permanente agitatie, zijn hun beweging alleen van vertaling.
- Af en toe botsen de deeltjes elastisch, met elkaar en met de wanden van de container. In totaal elastische schokken wordt kinetische energie bewaard gebleven.
- Er zijn geen aantrekkelijke krachten tussen moleculen. De enige interacties zijn te wijten aan botsingen die van tijd tot tijd en voor een zeer korte tijd plaatsvinden. Van de rest werkt elk molecuul ongeacht de anderen.
- Als er geen externe krachten zijn die op het deeltjessysteem werken, worden deze uniform verdeeld over het beschikbare volume.
Hoewel dit het eenvoudigste model is, legt het gedrag uit van eventueel dicht gas bij hoge temperaturen en lage drukken. Wetenschappers hebben andere beter aangepaste modellen ontwikkeld voor het gedrag van echte gassen, hiervoor beschouwen ze dat:
- De moleculen hebben een meetbare grootte.
- Intermoleculaire krachten worden niet geannuleerd.
Ideale gasvergelijking
Dankzij de postulaten van het ideale gas ontstaat een uitdrukking die de macroscopische grootten van de druk P, Volume V en Temperatuur T relateert:
P ∙ v = nrt
Waarbij n het aantal mol gas is en R de universele constante van gassen is, waarvan de waarde in internationale systeemeenheden 8 is.314 J/Mol ∙ K.
Kinetische energie en temperatuur
In een ideaal gas manifesteert alle interne energie zich als kinetische energie. De gemiddelde kinetische energie van de N -moleculen van een ideaal gas is recht evenredig met de temperatuur in Kelvin:
Corpusculair model in vloeistoffen en vaste stoffen
Eigenlijk is alle materie te vinden in de drie eenvoudigste toestanden: zoals gas, vloeistof of vaste stof, afhankelijk van de druk en temperatuur. Er zijn andere aggregatietoestanden zoals plasma, maar niet dicht bij het aardoppervlak.
Deze toestanden zijn te wijten aan de manier waarop intermoleculaire aantrekkingskrachten werken, die kort zijn, dat wil zeggen dat ze niet werken als de afstand tussen moleculen erg groot is en de deeltjes met hoge snelheid bewegen. Dit is het geval van gassen, waardoor het fenomeen van de diffusie sneller. Dit verklaart dat het aroma zich snel verspreidt door het aroma te ontdekken.
Kan u van dienst zijn: wat is het magnetische moment?Aan de andere kant, wanneer de deeltjes dichterbij zijn en hun beweging langzamer is, zoals in vloeistoffen en vaste stoffen, hebben deze intermoleculaire krachten de mogelijkheid om hun actie uit te oefenen.
Dus wanneer een gas naar de vloeibare toestand gaat, neemt het volume af, omdat de afstand tussen zijn deeltjes afneemt, en nog meer wanneer het vast wordt.
Materie in vloeibare toestand
In de vloeibare toestand zijn intermoleculaire krachten niet verachtelijk, maar werken op kleinere schaal dan in de vaste toestand. De deeltjes vormen kleine groepen, die continu uiteenvallen en zich hergroeperen, waardoor het materiaal mobiliteit biedt, hoewel ze een vast volume behouden.
Met deze mobiliteit kunnen vloeistoffen zich aanpassen aan de vorm van de container en geeft ze de mogelijkheid om te stromen, naast het gemakkelijker kunnen mengen. De diffusie kan optreden, maar langzamer dan in gassen.
Toch hebben de deeltjes voldoende cohesie zodat de vloeistof niet in een breed temperatuurbereik blijft.
Oppervlaktespanning
Op het oppervlak van de vloeistof zijn er moleculen waarop onevenwichtige intermoleculaire krachten werken, wat aanleiding geeft tot een netto kracht omhoog. Deze netto kracht wordt geminimaliseerd wanneer de vloeistof het laagst mogelijke oppervlak heeft.
Dankzij deze kracht slagen er ppens, clips, insecten en andere kleine objecten in om op het stille oppervlak van het water te blijven zonder te zinken.
 In dit beeld is een molecuul te zien op het oppervlak van de vloeistof, waarop een netto kracht omhoog werkt, waardoor het insect op het water kan lopen zonder te zinken
In dit beeld is een molecuul te zien op het oppervlak van de vloeistof, waarop een netto kracht omhoog werkt, waardoor het insect op het water kan lopen zonder te zinken Solid State Matter
In vaste toestand zijn de deeltjes zeer dicht bij elkaar en de intermoleculaire krachten laten de deeltjes in vaste posities blijven. Hoewel ze rond deze positie kunnen trillen, nemen vaste stoffen een gedefinieerde vorm aan en handhaven ze hun constante volume.
Wanneer warmte stroomt, neemt de amplitude van de vibrerende beweging toe en neemt de temperatuur toe. Dit zorgt ervoor dat de lichaamsdimensies toenemen met de temperatuur, een fenomeen genoemd Thermische verwijding. Als voldoende warmte stroomt, kan de vaste stof zelfs naar de vloeibare fase gaan.


