Huidig atoommodel

- 4556
- 799
- Alton D'Amore
Wat is het huidige atoommodel?
Hij Huidig atoommodel Het is degene gebaseerd op kwantummechanica, met name in de Schrödinger -vergelijking, in het principe van uitsluiting van Pauli en een eigendom van het elektron genaamd spinnen of Spin.
Het is het model van de grootste acceptatie en gebruik bij de studie van de structuur van atomen, moleculen en in de chemische reactiviteit van de elementen, vanwege de precisie van hun voorspellingen en hun relatieve eenvoud.
 Figuur 1. Waterstofatoom in een opgewonden toestand en zijn atoomnummers: energie n = 4, hoekmomentum l = 3 en magnetisch moment m = 1. Bron: Wikimedia Commons.
Figuur 1. Waterstofatoom in een opgewonden toestand en zijn atoomnummers: energie n = 4, hoekmomentum l = 3 en magnetisch moment m = 1. Bron: Wikimedia Commons. Dit model is de evolutie van verschillende eerdere atoommodellen, zoals het Rutherford -model en dat van Bohr - Sommerfeld, beschouwd als klassieke of semi -klassieke modellen.
Er zijn momenteel theoretisch completere modellen dan het typisische model van Schrödinger, zoals het Dirac-Jordan-model, dat speciale relativiteitstheorie omvat en is gebaseerd op de Dirac-golfvergelijking. In deze vergelijking verschijnt de spin, de eigenschap van de in het begin genoemde elektronen, op natuurlijke wijze.
Er zijn ook modellen gebaseerd op de kwantumveldtheorie, toegepast in fysica met veel energie. Deze modellen zijn uitstekend in de voorspelling van het creëren en vernietigen van fundamentele deeltjes, het doel van dit gebied van fysica.
Het is vermeldenswaard dat de meest geavanceerde theorieën convergeren naar dezelfde resultaten als die van de Schrödinger -vergelijking, vooral voor lichte atomen.
Huidige atoommodelkenmerken
In de visie van het huidige atoom, gebaseerd op niet-relativistische kwantum, is er geen concept van elektronische banen in de stijl van planetaire systemen.
Het meest voorkomende beeld van het atoom is echter nog steeds dat van een positieve centrale kern en sommige negatieve elektrische ladingstippen (elektronen), waardoor perfect gedefinieerde banen rond de centrale kern worden ingesneden. Maar ondanks zijn wortels komt het niet langer overeen met het huidige atoommodel.
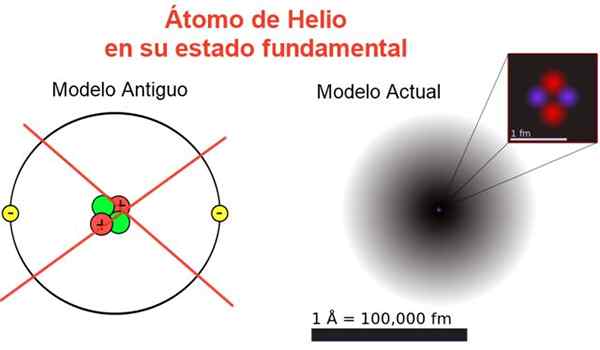 Figuur 2. Klassiek en huidige beeld van het heliumatoom in zijn fundamentele staat. In het huidige model zijn de twee elektronen van het heliumatoom verspreid in een regio genaamd Orbital. Bron: Wikimedia Commons, uw eigen compositie.
Figuur 2. Klassiek en huidige beeld van het heliumatoom in zijn fundamentele staat. In het huidige model zijn de twee elektronen van het heliumatoom verspreid in een regio genaamd Orbital. Bron: Wikimedia Commons, uw eigen compositie. Figuur 2 toont het oude beeld en het huidige beeld van een heliumatoom in zijn kleinere energietoestand (niveau n = 1 en l = 0).
Het kan u van dienst zijn: gemiddelde versnelling: hoe het wordt berekend en opgelostHet klassieke beeld is handig om te zien dat de kern twee protonen en twee neutronen bevat. Het garanderen van de neutraliteit van het atoom zijn er twee elektronen die hetzelfde energieniveau bezetten.
Uit de rest is het een beeld weg van de realiteit, omdat de schaal van de kern niet eens overeenkomt met die van het atoom: de kern is 1/100000 keer zo groot.
Onda dualiteit - deeltje
Klassieke mechanica stelt vast dat elk materiaaldeeltje een bijbehorende golf heeft, genaamd Golf functie. Dit is de beroemde Onda-deeltje dualiteit Van Louis de Broglie.
In het huidige atoommodel is het gedrag van het elektron op de schaal van de atomen prominent golvend, terwijl op macroscopisch niveau, zoals de elektronen die in de kathodestraalbuizen van de oude televisies bewegen, het corpusculaire gedrag overheerst.
Aan de andere kant, met fotonen, gebeurt het integendeel, in de meeste optische fenomenen (op macroscopisch niveau) hebben ze fundamenteel golvend gedrag. En wanneer ze interageren met zaken van materie, hebben ze een deeltjesgedrag.
Daarom zijn elektronen rond de kern verspreid naar gebieden die worden genoemd atomaire orbitalen, waarvan de vorm en uitbreiding afhangen van het energieniveau van de elektronen en het hoekmomentum.
Zowel energie als het hoekmomentum van het elektron rond de kern hebben bepaalde toegestane waarden, daarom wordt gezegd dat ze dat zijn gekwantiseerd.
De Schrödinger -golfvergelijking voorspelt welke energiewaarden en hoekmomentum zijn toegestaan, evenals de golffunctie geassocieerd met elke energie- en momentumniveau.
Het wiskundige vierkant van de golffunctie bepaalt de orbitalen, dat wil zeggen de gebieden rond de kern waar elektronen waarschijnlijker kunnen worden gevonden.
De atoommaat
Om een schaalbeeld van het huidige atoommodel te hebben, laten we ons voorstellen dat een atoom een diameter heeft zoals die van een voetbalveld. De kern zou als een mier in het midden van het veld zijn, maar verrassend met 99,9% van de atoommassa.
Aan de andere kant zouden elektronen zo diffuse spookachtige spelers over het hele veld zijn, met een grotere kans om op het middenveld te worden gevonden.
Kan u van dienst zijn: categorische variabele: kenmerken en voorbeeldenEr zijn een paar uitlijningen of toegestane manieren om het veld te bezetten, die afhankelijk zijn van de energie van de spelers (elektronen) en de hoeveelheid "draai" of rond het midden draaien.
Huidig atoommodel postuleert
1.- Het elektron wordt gekenmerkt door zijn massa M, door zijn spin S En omdat het het elementaire negatieve belastingsdragerdeeltje (-e) is.
2.- De elektronen hebben dubbel, golfvormig gedrag, maar afhankelijk van hun energie en de schaal van het fenomeen kan meer overwegend zijn dan de andere.
3.- De elektronen omringen de positieve atoomkern, zodat ze de elektrische neutraliteit van het atoom garanderen. Daarom is de hoeveelheid elektronen gelijk aan die van protonen; Dit is de atoomnummer, Dat verleent de chemische en fysische kenmerken van elk element.
4.- De interactie tussen elektronen en kern wordt gemodelleerd door potentiële V (R) Coulomb's elektrostatisch, die is opgenomen in de term potentiële energie in de Hamiltoniaanse operator.
5.- De term kinetische energie in de Hamiltoniaanse operator is een operator die is gebouwd van de lineaire momentumoperator, die hetzelfde is:
P = - i ħ ∂ /∂R
Waar ħ ħ ħ is, is de constante van Planck gedeeld door 2π.
6.- De Hamiltoniaanse operator H = (P⋅P)/2m - e v (R) werken op de elektronegolffunctie ψ (R)).
7.- Naarmate de stationaire oplossingen van de elektronische golffunctie worden gezocht, wordt de onafhankelijke Schrödinger -tijdvergelijking gebruikt:
H ψ (R) = E ψ (R))
Waarbij E de totale energie van het elektron vertegenwoordigt.
8.- In atomen met verschillende elektronen wordt er geen rekening gehouden met de interactie tussen hen.
9.- Als het gaat om atomen van veel elektronen, worden de orbitalen van de buitenste elektronen gemodelleerd door het potentieel van de afgeschermde kern door de meest interne elektronen, die bekend staat als Debye -potentieel.
10.- Vergelijking (7) heeft een oplossing voor sommige discrete energiewaarden, zodat beroemdheden Hoeveel van Planck, Ze verschijnen natuurlijk uit de vergelijkingsoplossingen van Schrödinger.
Het kan u van dienst zijn: stationaire golven: formules, kenmerken, typen, voorbeeldenelf.- Voor elke discrete waarde is er een golffunctie. Maar sommige oplossingen worden gedegenereerd, afhankelijk van de waarde van hoekmomentum L.
12.- De golffunctie is het product van een radiale functie, de azimutale functie en de polaire functie.
13.- Deze golffunctie bepaalt de toegestane regio's voor het elektron. Het vierkant van de golffunctie is het kansdichtheid Om het elektron in een bepaalde positie te vinden, gezien vanuit het midden van de atoomkern.
14.- De spin verschijnt niet in de Schrödinger -vergelijking, maar wordt via het Pauli -principe opgenomen in het atoommodel:
Het elektron is een fermion met twee mogelijke toestanden van spin +½ en -½.
Dus dezelfde toestand die wordt gekenmerkt door kwantumaantallen N, L, M van de Schrödinger -vergelijking, kan maximaal worden bezet door 2 elektronen met tegengestelde tegenpolen tegengesteld. Op deze manier wordt de Espin het vierde kwantumnummer.
Invloedrijke wetenschappers in het huidige atoommodel
Het lijkt ongelooflijk, maar de meeste fysici die hebben bijgedragen aan het huidige atoommodel verschijnen op dezelfde foto. Ze verzamelden zich in de beroemde conferenties gesponsord door Ernest Solvay, een chemicus en industrie van Belgische afkomst, die beroemd werd in de wereld van de wetenschap.
Ze begonnen sinds 1911 te worden gehouden en brachten de grootste wetenschappers van dit moment samen, onder hen waren vrijwel iedereen die hun bijdrage aan het huidige atoommodel leverde.
De beroemdste van deze conferenties werd in 1927 in Brussel gehouden en daar werd deze historische foto genomen:
 figuur 3. 1927 Solvay Conference -deelnemers in Brussel. Bron: Wikimedia Commons.
figuur 3. 1927 Solvay Conference -deelnemers in Brussel. Bron: Wikimedia Commons.  Figuur 4. De deelnemers aan de Solvay 1927 -conferentie.
Figuur 4. De deelnemers aan de Solvay 1927 -conferentie. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max geboren
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels bohr
- Owen Williams Richardson
Interessante artikelen
Schrödinger atomair model.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -atoommodel.
Bohr Atomic Model.
Referenties
- Alonso - Finn. Kwantum- en statistische stichtingen. Addison Wesley.
- Bauer, W. 2011. Fysica voor engineering en wetenschappen. Deel 1. MC Graw Hill.
- Eisberg en Resnick. Kwantumfysica. Limusa - Wiley.
- Wikipedia. Atoom theorie. Hersteld van: is.Wikipedia.com
- Zapata F. Typocuantisch model van het atoom. Opgehaald uit: lifer.com

