Myoglobine

- 4885
- 1397
- Glen Armstrong
 Myoglobinestructuur
Myoglobinestructuur Wat is myoglobine?
De Myoglobine Het is een intracellulair bolvormig eiwit dat wordt aangetroffen in de cytosol van skelet- en hartspiercellen. De fundamentele functie is om een zuurstofreserve te vormen en de voorkeur te geven aan intracellulair zuurstoftransport.
John Kendrew en Max Perutz ontvingen de Nobelprijs voor de chemie in 1962 voor hun studies over bolvormige eiwitten. Deze auteurs verduidelijken respectievelijk de drie -dimensionale structuur van respectievelijk myoglobine en hemoglobine. Historisch gezien was myoglobine een van de eerste eiwitten waarvan de drie -dimensionale structuur werd bepaald.
Globulaire eiwitten zijn compacte moleculen met een bolvormige vorm; Ze zijn oplosbaar in cytosol of in het lipidengedeelte van celmembranen. Ze zijn verantwoordelijk voor de belangrijkste biologische acties, in tegenstelling tot vezelachtige eiwitten, waarvan de belangrijkste functies structureel zijn.
Myoglobine geeft vers vlees rood. Dit gebeurt wanneer myoglobine wordt geoxygeneerd als oximioglobine en het ijzer dat het samenstelt, is het in ijzer in ijzer: mb-fe2+o2.
Wanneer het vlees wordt blootgesteld aan de omgeving, ferro, onstabiel, geoxideerd en ferrisch worden en onder deze omstandigheden verandert de kleur in bruine tonen voor de vorming van metamioglobine (MB-FE3 + + O2 ●-).
Normaal gesproken zijn de niveaus van bloedmyglobine erg klein, ze zijn in de volgorde van microgrammen per liter (μg/l). Deze niveaus nemen toe wanneer spiervernietiging optreedt zoals bij rabdomyolyse van skeletspier of in het geval van hartinfarct met weefselvernietiging en bij sommige myopathieën.
De aanwezigheid ervan in urine wordt waargenomen in bepaalde omstandigheden waarin weefselschade erg belangrijk is. De vroege diagnostische waarde voor hartinfarct is discutabel.
Kan u van dienst zijn: Cell CoreMyoglobinestructuur
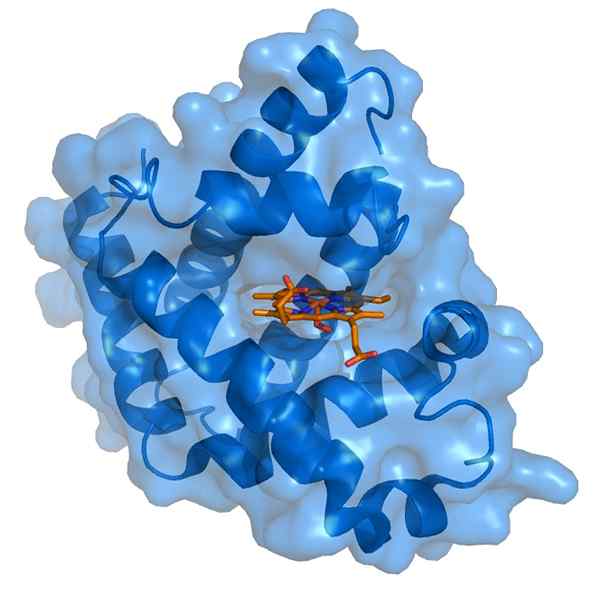 Myoglobin en zijn hemo prothetische groep (bron: Thomas SplettsSer/CC by-s (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons)
Myoglobin en zijn hemo prothetische groep (bron: Thomas SplettsSer/CC by-s (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons) Myoglobine heeft een molecuulgewicht van bijna 18 kDa inclusief de Hemo -groep. Het bestaat uit vier spiraalvormige segmenten verenigd door "plotselinge beurten". Deze myoglobine -propellers zijn nauw verpakt en handhaven hun structurele integriteit, zelfs wanneer de Hemo -groep wordt verwijderd.
De structuur van bolvormige eiwitten, evenals alle cel -eiwitten, is hiërarchisch, dus de structuur van myoglobine is ook. Het eerste niveau is de primaire structuur gevormd door de lineaire sequentie van aminozuren en myoglobine bestaat uit een 153 aminozuurketen.
De secundaire structuur van myoglobine bestaat uit de vorming van alfa -propeller. Myoglobine bevat 8 alfa -propellers gevormd door herhaalde polypeptidegedeelten die binden door korte aperiadische managementsegmenten.
De tertiaire structuur bestaat uit drie -dimensionale conformatie met biologische activiteit. De belangrijkste kenmerken van deze structuur zijn vouwen. De quaternaire structuur verwijst naar de assemblage van twee of meer afzonderlijke en verenigde polypeptideketens door niet -covalente links of interacties.
Myoglobine heeft een zeer compacte structuur, met hydrofoob afval gericht op het interieur en hydrofiele of polaire residuen naar buiten gericht. Intern apolair afval wordt gevormd door leucine, valine, methodine en fenylalanine. Het enige interne polaire afval zijn twee histidines die functies hebben in het actieve centrum.
De hemo -prothetische groep bevindt zich in een kloof van het apolaire binnenste deel van de polyloglobine polypeptideketen. Deze groep bevat ijzer in de vorm van ijzer van ijzer, die bindt aan zuurstof om oximioglobine te vormen.
Kan u bedienen: GLUT4: Kenmerken, structuur, functiesMyoglobine -functie
De functie van myoglobine is om zuurstof te verenigen met de Hemo -groep van zijn structuur en een zuurstofreserve te vormen voor spierfunctie. Voor zover zuurstof vastzit in de structuur van myoglobine in het cytoplasma van de spiercel, blijft de intracellulaire druk, bepaald door vrije zuurstof, laag.
De lage intracellulaire zuurstofdruk handhaaft de gradiënt voor zuurstofinlaat naar de cel. Dit bevordert de doorgang van zuurstof van de bloedsomloopstroom naar de spiercel. Wanneer myoglobine intracellulaire zuurstof verzadigt, neemt toe, wat de gradiënt geleidelijk vermindert en dus de overdracht vermindert.
De zuurstofbindingscurve aan myoglobine is hyperbolisch. In de initiële delen van de curve produceren kleine veranderingen in de gedeeltelijke zuurstofdruk grote veranderingen in de verzadiging van myoglobine met zuurstof.
Vervolgens, in de mate dat gedeeltelijke zuurstofdruk toeneemt, blijft de verzadiging toenemen, maar langzamer, dat wil zeggen, een veel grotere toename van de gedeeltelijke zuurstofdruk is nodig om de verzadiging van myoglobine te vergroten, en geleidelijk is de curve afgevlakt.
Er is een variabele die de affiniteit van de curve genaamd P50 meet, dit vertegenwoordigt de gedeeltelijke zuurstofdruk die nodig is om de myoglobine in een oplossing met 50% te verzadigen. Dus als de P50 toeneemt, wordt gezegd dat myoglobine minder affiniteit heeft en als de P50 afneemt, wordt gezegd dat myoglobine een grotere affiniteit heeft voor zuurstof.
Kan u van dienst zijn: proeritroblast: kenmerken, morfologie, regulering, kleuringWanneer de zuurstofbindingscurves met myoglobine en hemoglobine worden onderzocht, wordt waargenomen dat voor elke gedeeltelijke zuurstofdruk myoglobine verzadigd is in plaats van hemoglobine, wat aangeeft dat myoglobine een grotere affiniteit heeft voor zuurstof dan de zuurstof dan de zuurstof dan de zuurstof dan hemoglobine.
Soorten spiervezels en myoglobine
De skeletspieren hebben verschillende soorten spiervezels in hun samenstelling, sommige langzame contractie -oproepen en andere van snelle contractie. Snelle samentrekking vezels zijn structureel en metabolisch aangepast aan snel en krachtig en krachtig en op een anaërobe manier.
Langzame contractie vezels zijn aangepast voor lage snelheid, maar meer langdurige contracties, typisch voor aerobe weerstandsoefeningen. Een van de structurele verschillen van deze vezels is de concentratie van myoglobine, die hen de naam witte en rode vezels geeft.
Rode vezels hebben een hoog myoglobinegehalte, dat hen rode kleur geeft, maar waardoor ze ook grote hoeveelheden zuurstof kunnen behouden, wat onmisbaar is voor hun functie.
Normale waarden
Normale bloedwaarden voor mannen zijn van 19 tot 92 µg/l en bij vrouwen van 12 tot 76 µg/L, er zijn echter verschillen in waarden in verschillende laboratoria.
Deze waarden nemen toe wanneer spiervernietiging optreedt als bij rabdomyolyse van skeletspier, bij uitgebreide brandwonden, elektrische schokken of in uitgebreide spiernecrose als gevolg van arteriële occlusie, in hartinfarct en in sommige myopathieën.
Onder deze omstandigheden verschijnt myoglobine in urine en geeft het een karakteristieke kleur.

