Molaire massa hoe het wordt berekend, voorbeelden en oefeningen opgelost
- 3587
- 682
- Lonnie Rohan
De Molaire massa Het is een intensieve eigenschap van materie die het concept van mol relateert aan massametingen. Omdat het beknopter is, is het de hoeveelheid massa die overeenkomt met een mol substantie; Dat wil zeggen, wat een Avogadro -nummer "weegt" (6.022 · 1023) van bepaalde deeltjes.
Eén mol van elke stof zal hetzelfde aantal deeltjes bevatten (ionen, moleculen, atomen, enz.); De massa zal echter variëren omdat de moleculaire dimensies worden gedefinieerd door het aantal atomen en isotopen die de structuur vormen. Hoe meer massa het atoom of het molecuul, hoe grootste zijn molaire massa.
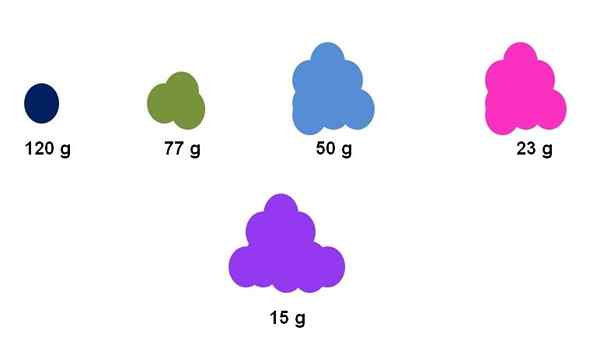
 Het verschil tussen de molaire massa's van verschillende stoffen kan oppervlakkig worden opgemerkt door de schijnbare hoeveelheid van hun monster. Bron: Gabriel Bolívar.
Het verschil tussen de molaire massa's van verschillende stoffen kan oppervlakkig worden opgemerkt door de schijnbare hoeveelheid van hun monster. Bron: Gabriel Bolívar. Stel bijvoorbeeld dat precies één mol samenkomt voor vijf verschillende verbindingen (superieure afbeelding). Met behulp van een balans is het deeg gemeten voor elk cluster, hieronder uitgedrukt. Deze massa komt overeen met molair deeg. Van allemaal is de paarse verbinding degene met de lichtere deeltjes, terwijl de donkerblauwe verbinding, de zwaarste deeltjes.
Merk op dat een algemene en overdreven neiging wordt getoond: hoe groter de molaire massa, hoe lager de hoeveelheid monster die in de balans moet worden geplaatst. Dit volume van materie hangt echter ook sterk af van de aggregatiestatus van elke verbinding en de dichtheid ervan.
[TOC]
Hoe wordt het molaire deeg berekend??

Definitie
De molaire massa kan worden berekend uit de definitie ervan: hoeveelheid massa per mol stof:
M = gram substantie /mol substantie
G/mol is in feite de eenheid waarin de molaire massa meestal tot expressie wordt gebracht, naast kg/mol. Dus als we weten hoeveel mol we hebben van een verbinding of element, en we wegen het, zullen we de molaire massa bereiken die een eenvoudige divisie toepassen.
Kan u van dienst zijn: Justus von LiebigItems
De molaire massa is niet alleen van toepassing op de verbindingen, maar ook op de elementen. Het concept van mollen discrimineert helemaal niet. Daarom plaatsen we met behulp van een periodieke tabel de relatieve atoommassa's voor een element van interesse en vermenigvuldigen we de waarde ervan met 1 g/mol; Dit is, Avogadro's constante, MOF.
De relatieve atoommassa van strontium is bijvoorbeeld 87,62. Als we de atomaire massa willen hebben, zou dit 87,62 uma zijn; Maar als wat we zoeken de molaire massa is, dan is het 87,62 g/mol (87,62 · 1 g/mol). En dus worden de molaire massa's van alle andere elementen op dezelfde manier verkregen, zonder zelfs dergelijke vermenigvuldiging te maken.
Verbindingen
De molaire massa van een verbinding is niets meer dan de som van de relatieve atomaire massa's van zijn atomen vermenigvuldigd door MOF.
Bijvoorbeeld het watermolecuul, h2Of het heeft drie atomen: twee waterstof en een van zuurstof. De relatieve atoommassa's van H en O zijn respectievelijk 1.008 en 15.999. Daarom voegen we de massa's toe die zich vermenigvuldigen met het atoomnummer dat aanwezig is in het samengestelde molecuul:
2 H · (1.008) = 2.016
1 O · (15.999) = 15.999
M(H2O) = (2.016 + 15.999) · 1 g/mol = 18,015 g/mol
Het is een vrij gebruikelijke praktijk om weg te laten MOF uiteindelijk:
M(H2O) = (2.016 + 15.999) = 18,015 g/mol
Het is wel verstaan dat het molaire deeg eenheden van g/mol heeft.
Voorbeelden
Een van de bekendste molaire massa's is zojuist genoemd: het water, 18 g/mol. Degenen die bekend raken met deze berekeningen, bereiken een punt waarop ze in staat zijn om sommige molaire massa's te onthouden zonder ze te zoeken of te berekenen zoals is gedaan. Sommige van deze molaire massa's, die als voorbeelden dienen, zijn de volgende:
Het kan u van dienst zijn: voor- en nadelen van gezondheidschemie-OF2: 32 g/mol
-N2: 28 g/mol
-NH3: 17 g/mol
-Ch4: 16 g/mol
-CO2: 44 g/mol
-HCl: 36,5 g/mol
-H2SW4: 98 g/mol
-Ch3COOH: 60 g/mol
-Geloof: 56 g/mol
Merk op dat de gegeven waarden zijn afgerond. Voor meer precieze doeleinden moeten molaire massa's met meer decimaal worden uitgedrukt en berekend met de juiste en exacte relatieve atoommassa's.
Opgeloste oefeningen
Oefening 1
Door analytische methoden werd geschat dat een monsteroplossing 0,0267 mol een analyt d. Het is ook bekend dat de massa ervan overeenkomt met 14% van een monster waarvan de totale massa 76 gram is. Bereken de molaire massa van de vermeende analyt d.
We moeten de massa van D bepalen die in de oplossing is opgelost. We gaan door:
Massa (d) = 76 g · 0,14 = 10,64 g d
Dat wil zeggen, we berekenen 14% van de 76 gram van het monster, die overeenkomen met de gram van de analyt d. Dan, en ten slotte, passen we de definitie van de molaire massa toe, omdat we voldoende gegevens hebben om deze te berekenen:
M(D) = 10,64 g d/ 0,0267 mol d
= 398,50 g/mol
Wat zich vertaalt als: één mol (6.022 · 1023) Van en heeft een massa gelijk aan 398,50 gram. Dankzij deze waarde kunnen we weten hoeveel van en we willen op de balans wegen voor het geval we bijvoorbeeld een oplossing van een molaire concentratie van 5 · 10 willen voorbereiden-3 M; dat wil zeggen, oplossen 0,1993 gram en in een liter oplosmiddel:
5 · 10-3 (mol/l) · (398,50 g/mol) = 0,1993 g en
Oefening 2
Bereken de molaire massa van citroenzuur wetende dat de moleculaire formule c is c6H8OF7.
Dezelfde formule c6H8OF7 Het vergemakkelijkt het begrip van de berekening, omdat het ons vertelt zodra het aantal atomen van C, H en of dat er in citruszuur is. Daarom herhalen we dezelfde stap gemaakt voor water:
Kan u van dienst zijn: dodecil natriumsulfaat (SDS): structuur, eigenschappen, gebruik6 C · (12.0107) = 72.0642
8 H · (1.008) = 8,064
7 o · (15.999) = 111.993
M(citroenzuur) = 72.0642 + 8.064 + 111.993
= 192,1212 g/mol
Oefening 3
Bereken het molaire deeg van pentahydraat kopersulfaat, cuo4· 5h2OF.
We weten voordat de molaire watermassa 18.015 g/mol is. Dit dient om de berekeningen te vereenvoudigen, omdat we het voorlopig weglaten en ons concentreren op het watervrije zout4.
We hebben dat de relatieve atoommassa's van koper en zwavel respectievelijk 63.546 en 32.065 zijn. Met deze gegevens gaan we op dezelfde manier verder als bij Oefening 2:
1 Cu · (63.546) = 63.546
1 S · (32.065) = 32.065
4 O · (15.999) = 63.996
M(CUSO4) = 63.546 + 32.065 + 63.996
= 159,607 g/mol
Maar we zijn geïnteresseerd in het molaire deeg van pentahydraatzout, niet de watervrij. Om dit te doen, moeten we de overeenkomstige massa van het water aan het resultaat toevoegen:
5 H2O = 5 · (18.015) = 90.075
M(CUSO4· 5h2O) = 159,607 + 90.075
= 249,682 g/mol
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Molaire massa. Opgehaald uit: in.Wikipedia.borg
- Nissa Garcia. (2020). Wat is molaire massa? Definitie, formule en examens. Studie. Hersteld van: studie.com
- Dr. Kristy M. Bailey. (S.F.)). Stoichiometry Tutorial
Molaire massa vinden. Opgehaald uit: Occ.Edu - Helmestine, Anne Marie, pH.D. (2 december 2019). Molair massa voorbeeldprobleem. Hersteld van: Thoughtco.com
- « Darmstadtio Discovery, structuur, eigenschappen, gebruik
- Water- of hydrologische cyclusfasen en belang »

