Lysine -kenmerken, structuur, functies, biosynthese
- 4995
- 916
- Alton D'Amore
De lysine ((Lys, K) of de ε-diaminoproïnezuur, Het is een van de 22 aminozuren die maken.
Het werd ontdekt door Drechsel in 1889 als een product van hydrolyse (ontleding) van caseinogeen. Jaren later bepaalden Fischer, Siegfried en Hedin dat het ook deel uitmaakte van eiwitten zoals gelatine, ei -albumine, conglutine, fibrine en andere eiwitten.
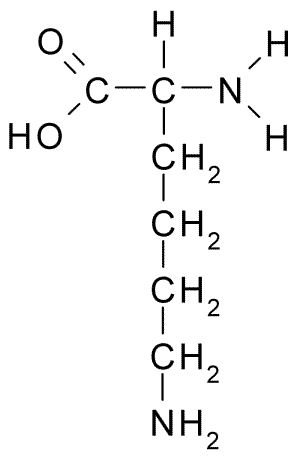
 Chemische structuur van het aminozuurlysine (Bron: Borb, via Wikimedia Commons)
Chemische structuur van het aminozuurlysine (Bron: Borb, via Wikimedia Commons) Het optreden ervan werd vervolgens aangetoond in zaadzaailingen in kieming en in de meeste onderzochte groente -eiwitten, die hun overvloed bepaalde als een algemeen bestanddeel van alle celeiwitten bepalen.
Het wordt beschouwd als een van de belangrijkste "beperkende" aminozuren in de diëten die rijk zijn aan granen en om deze reden wordt gedacht dat de kwaliteit van het eiwitgehalte dat wordt verbruikt door de verschillende onderontwikkelde populaties van de wereld wordt getroffen.
Sommige studies hebben vastgesteld dat lysine -inname de productie en afgifte van insuline- en glucagonhormonen bevordert, wat belangrijke effecten heeft op het energiemetabolisme van het lichaam.
[TOC]
Kenmerken
Lysine is een positief geladen a-aminozuur.53, wat impliceert dat, fysiologische pH, uw substituent aminogroep volledig is geïoniseerd, waardoor een positieve netto belasting wordt verleend aan aminozuur.
Het optreden ervan in eiwitten van verschillende soorten levende organismen is bijna 6% en verschillende auteurs zijn van mening dat lysine essentieel is voor de juiste groei en herstel van weefsels.
De cellen hebben veel lysinederivaten, die een grote diversiteit van fysiologische functies vervullen. Hierin zijn hydroxilisine, methyl-lysine en anderen.
Het is een ketogeen aminozuur, dat impliceert dat het metabolisme ervan koolzuurhoudende skeletten van intermediaire substraten produceert voor moleculenvormingsroutes zoals acetyl-CoA, met de daaropvolgende vorming van ketonlichamen in de lever.
In tegenstelling tot andere essentiële aminozuren is dit geen glycogeen aminozuur. Met andere woorden, de afbraak ervan eindigt niet bij de productie van routes tussenpersonen die glucose produceren.
Structuur
Lysine wordt geclassificeerd binnen de groep basisaminozuren, waarvan de zijketens ioniseerbare groepen hebben met positieve belastingen.
De zijketen of R R-groep heeft een tweede primaire aminogroep bevestigd aan het koolstofatoom in de ε-positie van zijn alifatische keten, vandaar zijn naam "ε-aminocaproico".
Het heeft een α-koolstofatoom, waaraan een waterstofatoom, een aminogroep, een carboxylgroep en de R-zijketen R, gekenmerkt door de moleculaire formule (-CH2-CH2-CH2-NH3+) worden verbonden.
Omdat de laterale keten drie methyleengroepen heeft, en hoewel het lysinemolecuul een aminogroep heeft met positieve lading voor fysiologische pH, heeft deze groep R een sterk hydrofoob karakter, dus wordt het vaak "begraven" in eiwitstructuren, waardoor alleen de ε- aminogroep.
De aminogroep van de lysine -zijketen is zeer reactief en neemt meestal deel aan de actieve centra van veel eiwit met enzymatische activiteit.
Functie
Lysine, een essentieel aminozuur, vervult meerdere functies zoals micronutriënten, vooral bij mensen en andere dieren, maar het is ook metaboliet in verschillende organismen zoals bacteriën, gisten, planten en algen.
De kenmerken van de zijketen, met name die van de ε-aminogroep die is bevestigd aan de koolwaterstofketen die in staat is om waterstofbruggen te vormen, geven het speciale eigenschappen die het doen deelnemen aan katalytische reacties in verschillende soorten enzymen.
Het kan u van dienst zijn: Flora en Fauna van Zacatecas: meer representatieve soortenHet is erg belangrijk voor de normale groei en remodellering van de spieren. Bovendien is het een voorlopermolecuul voor carnitine, een samengestelde gesynthetiseerd in de lever, hersenen en nieren die verantwoordelijk zijn voor het transport van vetzuren naar mitochondriën voor energieproductie.
Dit aminozuur is ook noodzakelijk voor de synthese en collageenvorming, een belangrijk eiwit van het bindweefselsysteem in het menselijk lichaam, dus het draagt bij aan het behoud van de structuur van de huid en botten.
Het heeft experimenteel herkende functies in:
- De bescherming van darmen tegen stressvolle stimuli, verontreiniging met bacteriële en virale ziekteverwekkers, enz.
- Het verminderen van chronische angstsymptomen
- De voorkeur geven aan de groei van zuigelingen die groeien onder diëten van lage kwaliteit
Biosynthese
Mensen en andere zoogdieren kunnen de aminozuurlysine niet synthetiseren In vivo En het is om deze reden dat ze het moeten verkrijgen van dier- en planteneiwitten die zijn ingenomen met voedsel.
In de natuurlijke wereld zijn twee verschillende routes geëvolueerd voor de biosynthese van lysine: een die bacteriën, planten en schimmels "lager" gebruikt en een andere gebruikt door Euglénides en "superieure" schimmels.
Lysinebiosynthese in planten, lagere schimmels en bacteriën
In deze organismen wordt lysine verkregen uit diamineopimelinezuur door een 7 -step route die begint met pyruvaat en semi -ethisch aspartaat. Voor bacteriën impliceert deze route bijvoorbeeld de productie van lysine met het doel van (1) eiwitsynthese, (2) synthese van diaminopimellaat en synthese van (3) lysine die zal worden gebruikt in de celwand van Pepidoglin.
Het aspartaat, in organismen die deze route presenteren, geeft niet alleen aanleiding tot Lisina, maar ontleent ook de productie van metionine en preonine.
De uiteenlopende route in de semi -aart ASP.
Lysinebiosynthese in superieure en Euglénidos -schimmels
Lysinesynthese van novo In superieure schimmels en Euglénid-micro-organismen komt het voor via de L-a-aminoadipato intermediair, die op verschillende manieren vele keren wordt getransformeerd naar die in bacteriën en planten.
De route bestaat uit 8 enzymatische stappen, waarbij 7 vrije tussenpersonen betrokken zijn. De eerste helft van de route vindt plaats in de mitochondria en bereikt de synthese van a-aminoadipato. De omzetting van α-aminoadipato in L-lisine vindt later plaats in het cytosol.
- De eerste stap van de route bestaat uit de condensatie van de a-ketoglutaraat- en acetyl-CoA-moleculen door het enzymhomochitraatsynthase, dat homocitrinezuur oplevert.
- Homocitrinezuur is uitgedroogd in zuur Cis-Homoaconitisch, dat vervolgens wordt omgezet in homoisocitrinezuur door een homoaconitasa -enzym.
- Homoisocitrinezuur wordt geoxideerd door homoisocytraatdehydrogenase, dat de vorming van de tijdelijke oxyglutaraat bereikt, die een koolstofdioxidemolecuul (CO2) verliest en eindigt als a-catoadipinezuur.
- Deze laatste verbinding wordt getransamineerd door een glutamaatafhankelijk proces dankzij de werking van het aminotransferase-aminoadipaat-enzym, dat L-a-aminoadipinezuur produceert.
- De laterale keten van het L-a-aminoadipinezuur wordt gereduceerd tot L-a-α-aminoadipic-Δ-semi-assess.
- Sacoopine -reductase dan katalyz. Vervolgens wordt de imino verminderd en wordt de sacoopine verkregen.
- Ten slotte wordt de koolstof-nitrogene binding in het gedeelte glutamaat van sacaopine "gesneden" door het enzym sacraopine dehydrogenase, die zich overgeeft als eindproducten L-lisin en a-zetoglutaraatzuur.
Alternatieven voor lysine
Experimentele tests en analyses uitgevoerd met ratten in een periode van groei hebben toegestaan om te verduidelijken dat de ε-N-Acetyl-lysine kan lysine vervangen om de groei van jongeren te ondersteunen en dit dankzij de aanwezigheid van een enzym: ε-lisin acilase.
Het kan je bedienen: Affotische zone: kenmerken, flora, faunaDit enzym katalyseert de hydrolyse van de ε-N-acetyl-lysine om lysine te produceren en doet dit snel en in overvloedige hoeveelheden.
Degradatie
Bij alle zoogdieren wordt de eerste stap in lysine-afbraak gekatalyseerd door het lysine-2-oxoglutaraat-enzymreductase, in staat om lysine en a-oxoglutaraat om te zetten in sacalopine, een aminozuurderivaat aanwezig in dierenfysiologische vloeistoffen en wiens bestaan in hen werd gedemonstreerd en wiens bestaan in hen werd gedemonstreerd. eind jaren 60.
Sacroopine is terug naar α-aminoadipato 8-semialdehid en glutamaat door werking van het enzym sacaropine dehydrogenase. Een ander enzym is ook in staat om sacaropina te gebruiken als een substraat om te hydrolyseren.
Sacaropine, een van de belangrijkste metabole intermediairs in lysine -afbraak, heeft een vervangingssnelheid, in fysiologische omstandigheden, extreem hoog, dus het accumuleert niet in vloeistoffen of weefsels, die zijn aangetoond door de hoge activiteiten die zijn gevonden van ontwikkelaardehydrogenase.
De hoeveelheid en activiteit van de enzymen die betrokken zijn bij het metabolisme van lysine hangt echter grotendeels af van verschillende genetische aspecten van elke specifieke soort, omdat er intrinsieke variaties en specifieke controle- of regulatiemechanismen zijn.
"Sacaropinuria"
Er is een pathologische aandoening gerelateerd aan het overvloedige verlies van aminozuren zoals lysine, citruline en histidine door urine en dit staat bekend als "Saropinuria". Sacaropine is een aminozuurderivaat van het lysinemetabolisme dat wordt uitgescheiden samen met de drie aminozuren die worden genoemd in de urine van "saropinurische" patiënten.
Sacaropine werd aanvankelijk ontdekt in biergist en is een voorloper van lysine in deze micro -organismen. In andere eukaryotische organismen wordt deze verbinding geproduceerd tijdens de afbraak van lysine in de mitochondriën van de hepatocyten
Voedsel rijk aan lysine
Lysine wordt verkregen uit het voedsel dat wordt geconsumeerd met het dieet en een gemiddelde volwassen mens heeft minstens 0 nodig.8 g van deze dag. Het wordt gevonden in tal van eiwitten van dierlijke oorsprong, vooral in rood vlees zoals koeien, lam en kip.
Het is in vissen zoals tonijn en zalm en in vruchten van de zee zoals oesters, garnalen en mosselen. Het is ook aanwezig in de samenstellende eiwitten van zuivelproducten en hun derivaten.
In plantaardige voedingsmiddelen wordt gevonden in de aardappelen, in paprika's en in prei. Het is ook in avocado's, perziken en peren. In peulvruchten zoals Arriñonados -bonen, kikkererwten en soja; In pompoenpitten, in de noten van macadamia en in de anacardos (Merey, Marañón, enz.).
Voordelen van uw inname
Dit aminozuur is opgenomen in tal van nutraceutische formuleringsmedicijnen, dat wil zeggen geïsoleerd uit natuurlijke verbindingen, vooral planten.
Het wordt gebruikt als anticonvulsief en de effectiviteit ervan is ook aangetoond bij de remming van de replicatie van de Herpes simplex virus Type 1 (HSV-1), die zich meestal manifesteert in momenten van stress, wanneer het immuunsysteem depressief of "verzwakt" is als ampien of herpes op de lippen.
De effectiviteit van L-Lisine-supplementen voor de behandeling van lip herpes is te wijten aan het feit dat dit "concurreert" of "blokkeert" arginine, een ander eiwitaminozuur, dat nodig is voor de vermenigvuldiging van HSV-1.
Er is vastgesteld dat lysine ook anti-ansoolitaire effecten heeft, omdat het helpt bij het blokkeren van receptoren die betrokken zijn bij reacties op verschillende stressvolle stimuli, naast deelname aan de afname van de cortisolspiegels, "stresshormoon".
Sommige studies hebben aangetoond dat het nuttig kan zijn voor de remming van carcinogene tumoren, voor de gezondheid van de ogen, voor bloeddrukcontrole, onder anderen.
Kan u dienen: Cultuurmedia: geschiedenis, functie, typen, voorbereidingBij dieren
Een gemeenschappelijke strategie om herpes I -virusinfecties in kelines te behandelen is lysinesuppletie. Sommige wetenschappelijke publicaties stellen echter vast dat dit aminozuur niet, in keleins, geen antivirale eigenschap heeft, maar eerder werkt door de arginineconcentratie te verminderen.
In de gezondheid van baby's
De experimentele inname van L-Lisina, toegevoegd in kindermelk tijdens de borstvoedingperiode, is gunstig gebleken voor de winst van lichaamsmassa en inductie van eetlust bij kinderen tijdens de eerste stadia van postnatale ontwikkeling.
De overmaat L-lisine kan echter overdreven urinaire uitdringingen van aminozuren veroorzaken, zowel neutrale als basiskenmerken, wat resulteert in een lichaamsevenwicht daarvan.
De overmaat van L-Lisine-suppletie kan eindigen in de repressie van groei en andere histologische effecten die duidelijk zijn in belangrijke organen, waarschijnlijk vanwege het verlies van aminozuren met urine.
In dezelfde studie werd ook aangetoond dat lysine -suppletie de voedings eigenschappen van ingeslagen plantaardige eiwitten verbetert.
Andere soortgelijke studies uitgevoerd bij volwassenen en kinderen van beide geslachten in Ghana, Syrië en Bangladesh, brachten de gunstige eigenschappen van de inname.
Lysine -deficiëntiestoornissen
Lysine is, net als alle essentiële en niet -essentiële aminozuren, noodzakelijk voor de juiste synthese van celeiwitten die bijdragen aan de vorming van organische systemen.
Gemarkeerde lysineficiënties in het dieet, omdat het een essentieel aminozuur is dat niet door het lichaam wordt geproduceerd, kan leiden tot de ontwikkeling van angstige schilderijen gemedieerd door serotonine, naast diarree, ook gerelateerd aan serotoninereceptoren.
Referenties
- Kom, s., & Bunnik, en. M. (2015). Lysin -smeekbede is niet efectief voor de preventie of behandeling van katachtige herpesvirus 1 -infectie bij katten: een systematische review. BMC veterinair onderzoek, elf(1).
- Carson, n., Scally, B., Neill, D., & Carré, ik. (1968). Saccharopinuria: een nieuwe aangeboren fout van het lysinemetabolisme. Natuur, 218, 679.
- Colina R, J., Díaz E, M., Manzanilla M, L., Araque M, H., Martínez G, G., Rossini V, M., & Jerez-Timaure, n. (2015). Evaluatie van verteerbare lysinespiegels in diëten met een hoge energiedichtheid voor het afwerken van varkens. MVZ Córdoba Magazine, twintig(2), 4522.
- Fellows, b. F. C. Je., & Lewis, m. H. R. (1973). Lysinemetabolisme bij zoogdieren. Journal Biochemical, 136, 329-334.
- Fornazier, r. F., Azevedo, r. NAAR., Ferreira, r. R., & Varisi, v. NAAR. (2003). Lysine -katabolisme: stroom, metabole rol en regulatie. Braziliaanse tijdschrift van plantfysiologie, vijftien(1), 9-18.
- Ghosh, s., Smriga, m., Vuvor, f., Suri, D., Mohammed, h., Armah, s. M., & Scrimshaw, n. S. (2010). Effect van lysine-smeekbede op gezondheid en morbiditeit bij personen die behoren tot arme peri-urban huishoudens in Accra, Ghana. American Journal of Clinical Nutrition, 92(4), 928-939.
- Hutton, c. NAAR., Perugini, m. NAAR., & Gerrard, J. NAAR. (2007). Remming van lysinebiosynthese: een evoluerende antibiotische strategie. Moleculaire biosystemen, 3(7), 458-465.
- Kalogeropoul, D., Lafave, l., Schweim, K., Gannon, m. C., & Nuttall, f. Q. (2009). Lysine -inname verzwakt aanzienlijk de glucoserespons op ingenomen glucose zonder een verandering in de insuline -respons. American Journal of Clinical Nutrition, 90(2), 314-320.
- Nagai, h., & Takeshita, s. (1961). Voedingseffect van L-lysinesuppletie op de groei van zuigelingen en kinderen. Japanse pediatria, 4(8), 40-46.
- O'Brien, s. (2018). Gezondheidslijn. Ontvangen op 4 september 2019, van www.Gezondheidslijn.com/voeding/lysine-voor-benefits
- Zabriskie, T. M., & Jackson, m. D. (2000). Lysinebiosynthese en metabolisme in schimmels. Natuurlijke productrapporten, 17(1), 85-97.
- « De 25 beroemdste hackers in de geschiedenis
- Freud- en psychoanalyse -afweermechanismen (voorbeelden) »

