HESS Verklaringwetgeving, aanvragen, voorbeelden
- 3417
- 423
- Ernesto McKenzie
De Hess Law Het is een andere manifestatie van de wet op het gebied van energiebesparing die het mogelijk maakt om, door eenvoudige algebraïsche bedragen, de enthalpie van een chemische reactie te bepalen. Begrepen door enthalpie als de warmte die wordt afgegeven of geabsorbeerd, bij constante druk, die wordt geassocieerd met elke chemische reactie of chemisch fenomeen.
Enthalpies, ΔH, worden experimenteel bepaald met behulp van calorimetrie. Er zijn echter reacties die moeilijk te bestuderen zijn met deze techniek. Wanneer dit gebeurt, worden andere reacties gebruikt die hun specifieke enthalpieën hebben, en die de belangen of verbindingen bezitten die interesse.
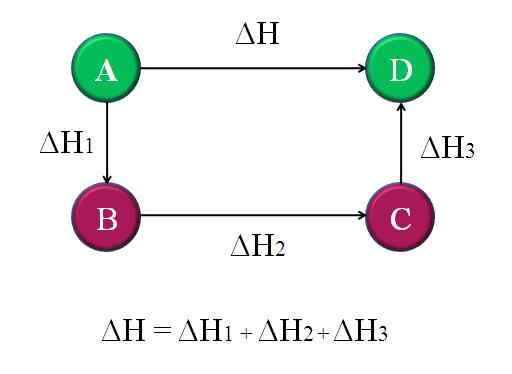
 Eenvoudig en algemeen diagram waar de HESS -wet voor vier chemische reacties wordt toegepast. Bron: Gabriel Bolívar.
Eenvoudig en algemeen diagram waar de HESS -wet voor vier chemische reacties wordt toegepast. Bron: Gabriel Bolívar. Op deze manier kan de "onbekende" AH van de reactie worden berekend. Het topdiagram helpt bijvoorbeeld om dit idee te begrijpen. Er zijn vier reacties: A-D, A-B, B-C en C-D. De A-D-reactie is degene die de grootste AH heeft, omdat ze zich bij het ware optreden, de meest beruchte chemische veranderingen.
De andere reacties hebben, hoewel, kleinere AH, omdat ze bestaan uit alternatieve stappen of alternatieve reacties om dezelfde producten te bereiken D. Daarom de som van ΔH1, AH2 en ΔH3, Het zal gelijk zijn aan ΔH. Dit weten, AH, of een andere enthalpie, kan worden berekend door eenvoudige toestanden toe te passen. Dit is de wet van Hess.
De wet van Hess is erg nuttig bij het berekenen van reactietealpieën, evenals het trainen van enthalpieën voor verschillende verbindingen of onstabiele tussenpersonen.
[TOC]
Verklaring van de wet van Hess
Berekening van de enthalpie van een reactie
De reden waarom het wordt vervuld dat:
ΔH = ΔH1 + AH2 + AH3
Het is omdat enthalpie, of de verandering van enthalpie, een staatsfunctie is. Dit betekent dat hun waarden niet worden gewijzigd door het aantal stappen, fasen of intermediaire reacties. Ah zal bijvoorbeeld hetzelfde blijven, zelfs als er een AH is10 dat moet worden overwogen in de algebraïsche som.
Enthalpies kunnen worden gevisualiseerd als de toppen van sommige bergen. Het maakt niet uit hoe de stappen naar hen worden gericht, de hoogte die hen van het Mar -niveau scheidt, zal nooit variëren. En precies het zijn de hoogten die worden toegevoegd of afgetrokken om de onbekende hoogte van een omliggende berg te bepalen.
Terugkerend naar het vorige diagram: a, het is een berg, van een andere berg, enzovoort. Het hoogteverschil tussen a en d tops is het grootste. Door de hoogten toe te voegen tussen A-B, B-C en C-D, zal het gelijk zijn aan A-D-hoogte. Dit is wat er wordt gedaan met de enthalpieën van hun respectieve chemische reacties.
Kan u van dienst zijn: fosfaatgroepEnthalpie van een reactie van enthalpies van formaties
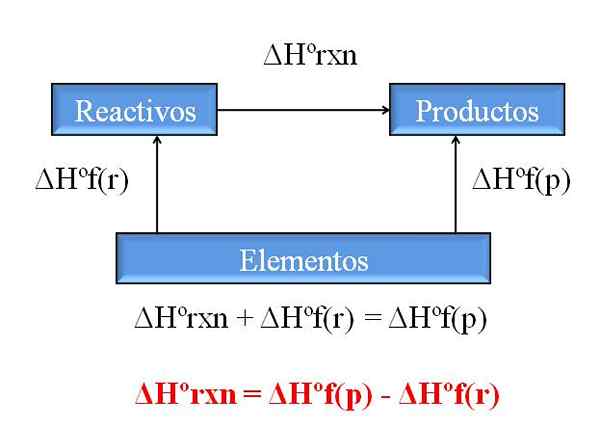 Algemeen diagram om de enthalpie te berekenen van een reactie van enthalpieën van formaties. Bron: Gabriel Bolívar.
Algemeen diagram om de enthalpie te berekenen van een reactie van enthalpieën van formaties. Bron: Gabriel Bolívar. Een van de meest waardevolle gevolgen van de wet van Hess is dat het de bepaling van de enthalpieën van elke chemische reactie mogelijk maakt, waardoor de trainingsthalpieën van alle verbindingen (reagentia en producten) worden betrokken.
Het superieure beeld illustreert dit punt. Begrepen door enthalpie van bijbehorende warmtevorming wanneer een verbinding wordt gevormd uit zijn elementen. Deze enthalpie zou het maximaal mogelijke verschil worden tussen reagentia en producten, zonder de noodzaak om andere chemische reacties te raadplegen; Tenminste, buiten de afzonderlijke training van verbindingen.
Hoe lees je het diagram deze keer? Een truc is altijd om de enthalpies toe te voegen wanneer deze in de richting van de pijl gaat en ze af te trekken wanneer de pijl op de tegenovergestelde route staat. Aldus draagt ΔHºrxn, standaardreactie -enthalpie, bij aan ΔHºF (reagentia), standaard enthalpie van reagensvorming, en ze worden ΔHºF (producten), standaard enthalpie van productvorming van producten afgetrokken van producten.
Reacties sommen
De diagrammen kunnen zeer ingewikkeld worden om te interpreteren, vooral als er veel reacties zijn die moeten worden overwogen. Daarom wordt de som van de reacties gebruikt. Deze methode vergemakkelijkt de berekening van enthalpieën enorm en versnelt het begrip van de wet van Hess.
Stel bijvoorbeeld dat u de AHºrxn van de volgende reactie wilt bepalen:
A + B + C → ABC
En we hebben ook twee andere reacties:
A + B → AB (ΔHº1))
AB + C → ABC (ΔHº2))
Het is interessant dat A + B + C zich aan de linkerkant (reagentia) bevinden en dat ABC aan de rechterkant is (producten). Vervolgens gaan we gewoon door met het toevoegen van de laatste twee reacties:
A + B → AB
AB + C → ABC
A + AB + C → ABC + AB
Omdat AB van beide kanten is, wordt het geëlimineerd. En dus hebben we:
A + B + C → ABC
ΔHºrxn = ΔHº1 + ΔHº2
Door de reacties toe te voegen, wordt het gebruik van een diagram weggelaten.
Toepassingen van de wet van Hess
De wet van Hess staat, zonder de noodzaak van experimenten, enthalpies toe voor verschillende chemische reacties of fenomenen. Sommigen van hen worden vermeld:
- Enthalpies trainen voor onstabiele verbindingen of intermediairs, zoals we meestal hebben in organische chemie.
-Enthalpies van faseovergangen, in de studie van kristallijne vaste stoffen.
Kan u van dienst zijn: chemische verbinding-Enthalpies van allotrope overgangen, zoals die tussen grafiet en diamant.
Evenzo wordt de wet van Hess gebruikt om de reticulaire energie van een vaste stof te bepalen, en de elektronische affiniteiten van sommige atomen.
Voorbeelden: opgeloste oefeningen
- voorbeeld 1
Bereken de ΔHRXN van de volgende reactie:
2HCl (G) + F2(G) → 2HF (L) + Cl2(G)
Als u de volgende reacties en hun respectieve enthalpieën heeft:
4hcl (g) + of2(g) → 2H2Of (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2H2(g) + 1/2f2(g) → hf (l) (ΔH = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → h2Of (l) (ΔH = -285.8 kJ/mol)
Vergelijkingen bestellen
Om te beginnen moeten we de reacties zodanig toevoegen dat HCl en F2 zijn aan de linkerkant, en HF en CL2, Aan de rechterkant. Maar nog belangrijker, het merkt op dat zoveel h2 als h2Of zijn niet in de rentevergelijking. Daarom moeten we ze in de som annuleren en de stoichiometrische coëfficiënten samenvallen door vermenigvuldigingen:
2HCl (G) + 1/22(g) → h2Of (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Deze vergelijking werd vermenigvuldigd met 1/2 om 2HCl te hebben in plaats van 4HCl
H2(g) + f2(G) → 2HF (L) (ΔH = -600.0 kJ/mol) * (2)
Deze vergelijking vermenigvuldigde met 2 om F te hebben2 en geen 1/2f2
H2Of (l) → h2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
Ondertussen vermenigvuldigd met -1 om het "te draaien". We hebben dus de geordende vergelijkingen en klaar om toe te voegen.
Som van de vergelijkingen
Alles toevoegen geeft ons:
2HCl (G) + 1/22(g) → h2Of (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2(g) + f2(G) → 2HF (L) ΔH = -1200.0 kJ/mol)
H2Of (l) → h2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2HCl (G) + F2(G) → 2HF (L) +Cl2(G)
Merk op dat termen 1/22, H2Of en h2 Ze worden geannuleerd omdat ze zich aan beide zijden van de pijl bevinden. Enthalpies worden ook toegevoegd, gevend:
ΔHRX = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kJ/mol)
Deze uitdrukking is hetzelfde als het begin:
ΔH = ΔH1 + AH2 + AH3
En dus hebben we dat Ahrx gelijk is aan:
ΔHRX = -1015.4 kJ/mol
- Voorbeeld 2
In dit voorbeeld is te zien dat de enthalpieën van de alternatieve reacties overeenkomen met de enthalpieën van de vorming van interesseverbindingen.
Het is gewenst om AHRXN te bepalen voor de volgende ontledingsreactie:
2SO3(g) → 2So2(g) + of2(G)
En de trainingsthalpieën van de SO -verbindingen worden bij de hand geteld3 En dus2:
S (s) + o2(g) → Dus2(g) (ΔH = -296.8 kJ/mol)
Kan u van dienst zijn: isopreno: structuur, eigenschappen, toepassingenS (s) + 3/2o2(g) → Dus3(g) (ΔH = -395.6 kJ/mol)
Vergelijkingen bestellen
Deze oefening zal op dezelfde manier worden opgelost als het vorige voorbeeld. Het zou zo moeten zijn3 gelijk hebben en vermenigvuldigen met 2. Daarvoor moeten we de So Formation -vergelijking "draaien"3 het vermenigvuldigen met -1, en vervolgens door het met 2 te vermenigvuldigen:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
De SO -formatie -vergelijking2 We vermenigvuldigen het ook met 2:
2s (s) + 2e2(g) → 2So2(g) (ΔH = -296.8 kJ/mol) * (2)
Som van de vergelijkingen
Nu worden de vergelijkingen toegevoegd:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ/mol)
2s (s) + 2e2(g) → 2So2(g) (ΔH = -593.6 kJ/mol)
2SO3(g) → 2So2(g) + of2(G)
Merk op dat de term 2s wordt geëlimineerd omdat deze zich aan beide zijden van de pijl bevindt. Ook 3e2 2o wordt afgetrokken2 Een O geven2. De som van de enthalpieën, en daarom zal de waarde van ΔHRXN zijn:
ΔH = ΔHRXN = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Zoals elke ontledingsreactie is het endotherm, dus de enthalpie is positief.
Alternatieve methode
Er is een methode om hetzelfde resultaat te bereiken op een meer directe en eenvoudige manier. Dit werd in een vorige sectie genoemd.
2SO3(g) → 2So2(g) + of2(G)
Om de ΔHRXN van deze reactie te bepalen, moeten we ΔHºF (reagentia) en ΔHºF (producten) berekenen. De ΔHºF (dus3) is gelijk aan -395.6 kJ/mol, terwijl de ΔHºF (dus2) is gelijk aan -296.8 kJ/mol. De ΔHºF (of2) is gelijk aan 0, omdat elementaire zuurstof bestaat als een molecuul van O2 en niet als atomen of vrij.
Dus we hebben:
ΔHRXN = ΔHºF (producten) - ΔHºF (reagentia)
= [ΔHºF (dus2) + ΔHºF (of2)] - ΔHºF (dus3))
= ΔHºF (dus2) - ΔHºF (dus3))
We moeten beide trainingsthalpieën echter met 2 vermenigvuldigen, om de stoichiometrische coëfficiënten te evenaren met betrekking tot de chemische vergelijking:
ΔHrxn = 2ΔHºF (dus2) - 2AhºF (dus3))
En berekenen dat we hebben:
ΔHRXN = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
In feite is dit de manier waarop het meestal de voorkeur heeft om alle oefeningen op te lossen waarin de Hess -wet wordt toegepast.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Hess's wet. Opgehaald uit: in.Wikipedia.borg
- Cohen Shelly. (18 mei 2020). Hess's wet. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Clark Jim. (2010). Hess's wet- en enthalpie -verandering berekeningen. Hersteld van: chemguide.co.Uk
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Hess 'wetdefinitie. Hersteld van: Thoughtco.com
- Laura. (2020). Hess's Law: Definitie, Formule & Voorbeeld. Studie. Hersteld van: studie.com
- Kimitube. (2014). Theorie 14 Thermochemie: berekening van de enthalpie van een reactie van de wet van Hess. Hersteld van: Quimitube.com
- « Spanningstest hoe het wordt gedaan, eigenschappen, voorbeelden
- Compressietest hoe het wordt uitgevoerd, eigenschappen, voorbeelden »

