Henry's wet

- 2238
- 63
- Miss Herman Russel
 Henry's wet verklaart de bruisen van frisdranken
Henry's wet verklaart de bruisen van frisdranken Wat is de wet van Henry?
De Henry's wet Het is de relatie die het effect van druk op de oplosbaarheid van de gas beschrijft. Deze wet stelt vast dat de oplosbaarheid van een gas in contact met het oppervlak van een vloeistof bij een gegeven temperatuur recht evenredig is met de partiële druk van genoemd gas op de vloeistof.
Dit betekent dat, hoe groter de gasdruk op een vloeistof, hoe groter de totale hoeveelheid gas die erin kan worden opgelost, waardoor een grotere concentratie wordt verkregen (dat wil zeggen de oplosbaarheid).
Henry's wet, we zien het in actie elke keer dat we een frisdrankje ontdekken. Omdat het gesloten is, houdt hoge druk in de fles koolhydraatgas opgelost. Maar door het te ontdekken, neemt de gasdruk af, wat de oplosbaarheid ervan vermindert en ontsnapt aan bubbels en buiencence.
Henry's Law -formule
In wiskundige vorm wordt de wet van Henry uitgedrukt als een evenredigheidswet:
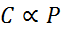
Deze evenredigheidswet wordt omgezet in:
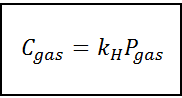
Waar C Het verwijst naar de maximale gasconcentratie in de vloeistof, dat wil zeggen de oplosbaarheid; Pgas Het is de partiële gasdruk in contact met de vloeistof en kH Het is een evenredigheidsconstante genoemd Henry's wet constant.
Gasconcentratie kan worden uitgedrukt in verschillende eenheden zoals molariteit, moliteit of molaire fractie. In de meeste gevallen gebruiken chemicaliën echter concentratie in molariteitseenheden (in mol/L), terwijl de druk tot expressie wordt gebracht in atmosferen.
Kan u van dienst zijn: anthraceen: wat is, structuur, eigenschappen, gebruikDe constante van de wet van Henry (kH))
De constante kH Beschrijf de interacties tussen een gas en een oplosmiddel. Hoe sterker deze interacties zijn, hoe groter de constante en daarom hoe groter de oplosbaarheid van het gas in het oplosmiddel bij een bepaalde temperatuur en druk.
Numeriek, de waarde van kH vertegenwoordigt de oplosbaarheid van het gas bij de gegeven temperatuur, wanneer de gedeeltelijke druk van hetzelfde 1 atm is.
Afhankelijk van de concentratie -eenheden en druk die in de vergelijking worden gebruikt, kan deze constante mol/L -eenheden hebben.ATM, mol/kg.ATM, etc.
De volgende tabel toont de waarden van de constante van de wet van Henry voor enkele gemeenschappelijke gassen in water bij 25 ° C:

Deze waarden nemen af met de temperatuur, omdat de oplosbaarheid van gassen in het algemeen afneemt bij een hogere temperatuur.
Verklaring van Henry's wet
De wet van Henry is heel gemakkelijk te begrijpen vanuit het oogpunt van microscopisch. We kunnen ons een gas voorstellen als een set zeer kleine deeltjes die stuiteren op alle oppervlakken die spelen. Wanneer ze botsen met het oppervlak van een vloeistof, zullen sommige deeltjes stuiteren, terwijl anderen het oppervlak kruisen dat vastzit (dat wil zeggen, ze zullen oplossen).
Hetzelfde geldt voor gasdeeltjes die zijn opgelost. Ze stuiteren met de wanden van de container en kunnen ook het oppervlak van de vloeistof bereiken, waar sommigen zullen stuiteren, terwijl anderen het oppervlak zullen oversteken en naar de gasfase ontsnappen.
Wanneer de balans wordt bereikt, zijn de snelheden waarmee het gas oplost in het oplosmiddel en waarmee het ontsnapt, dus de concentratie blijft constant.
Kan u van dienst zijn: mechanische eigenschappen van metalen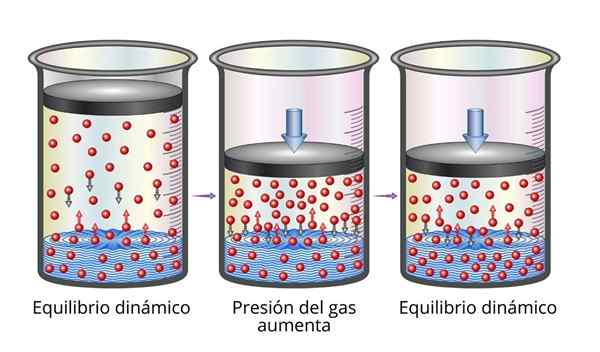 Verklaring van Henry's wet
Verklaring van Henry's wet Wanneer we de gasdruk verhogen, is het wat we doen om de frequentie te vergroten waarmee gasdeeltjes botsen met het vloeibare oppervlak. Dit maakt de snelheid waarmee het gas oplost, neemt toe. Wanneer een nieuwe balans wordt bereikt, zal de nieuwe gasconcentratie groter zijn.
Uitzonderingen op de wet van Henry
Het is belangrijk om te benadrukken dat de wet van Henry een ideale wet is, die alleen het gedrag van echte gasoplossingen onder bepaalde voorwaarden beschrijft. De wet van Henry kan dus alleen worden toegepast wanneer:
- De temperatuur blijft constant.
- Het gas is in balans met de oplossing.
- Gasdruk is relatief laag.
- Het gas reageert niet met het oplosmiddel.
Desondanks, zelfs in sommige gevallen waarin het gas reageert met het oplosmiddel, kan deze wet ongeveer worden toegepast.
Voorbeelden van toepassing van de wet van Henry
Voorbeeld 1: Bepaling van de constante van de wet van Henry
Het werd experimenteel bepaald dat de concentratie van een waterige oplossing in balans met neon bij een druk van 3,00 atm en 25 ° C 0,00135 mol/l is. Bepaal de constante van Henry's wet voor neon in water bij 25 ° C.
Oplossing:
Volgens de wet van Henry:
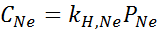
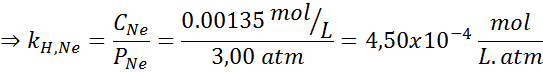
Daarom is de wet van Henry constant voor neon in water bij 25 ° C 4,50 x 10-4 mol/l.Geldautomaat.
Voorbeeld 2: Bepaling van de oplosbaarheid van een gas
Gebruik de constante van de wet van Henry in de vorige tabel, bepaal de oplosbaarheid van koolstofdioxide van de lucht in water op zeeniveau, wetende dat de molaire fractie van genoemd gas in de lucht 3,14 x 10 is-4.
Oplossing:
Op zeeniveau is de luchtdruk 1 atm en de gedeeltelijke druk van de CO2 Het wordt gegeven door:
Het kan u van dienst zijn: HYPOYODOUS AUR (HIO)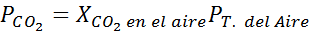
Deze uitdrukking vervangen in de wet van Henry:
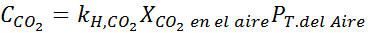
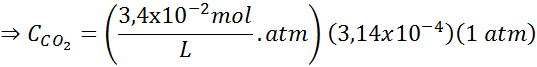
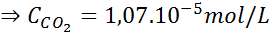
Voorbeeld 3: duikgassen
Wanneer een duiker niets op de diepten groter dan 30 meter is, moet een mengsel van lucht ademen met andere inerte gassen zoals helium of argon, omdat de toename van stikstofconcentratie in het voorspelde bloed door Henry's wet narcotische effecten heeft die desoriëntatie, verwarring en visie veroorzaken problemen.
Dit effect begint te observeren bij het ademen van lucht (xN2= 0,78) bij een druk van 4,00 atm. Als een duiker van plan is om tot 100 meter diep af te dalen, waar de druk ongeveer 11,0 atm is, wat is dan de maximale stikstoffractie die kan ademen voordat hij aan drugshandelaren lijdt?
Oplossing:
Op basis van de verklaring kunnen we afleiden dat de maximale stikstofconcentratie is wat er gebeurt wanneer luchtdruk 4,00 atm is. Volgens de wet van Henry en het gebruik van de relatie tussen totale druk en gedeeltelijke druk van het vorige voorbeeld:
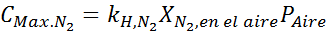
Dit moet dezelfde maximale concentratie zijn bij elke totale druk. Dus 100 meter:
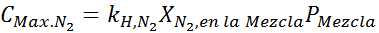
Het gelijkmaken van beide vergelijkingen, we kunnen de maximale molaire fractie stikstof in het mengsel vinden:
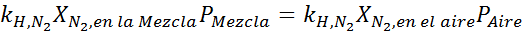
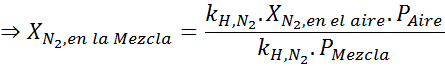
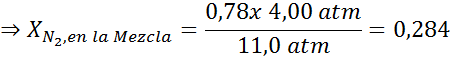
Dit betekent dat de duiker geen mengsel met meer dan 28,4% stikstof mag gebruiken als het van plan is om tot 100 meter diep te duiken.

