Avogadro Law
- 2590
- 801
- Kurt Aufderhar Jr.
Wat is de wet van Avogadro?
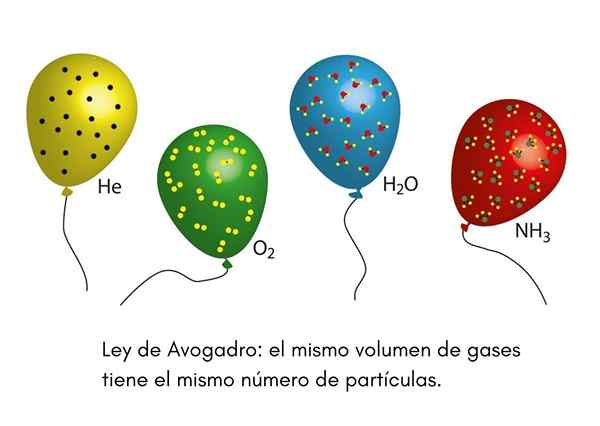
De Avogadro Law, Ook wel Avogadro -principe genoemd, het is een wet die van toepassing is op ideale gassen en werd verkondigd door een negentiende -eeuwse wetenschapper genaamd Amadeo Avogadro. Deze wet stelt vast dat twee gelijke volumes verschillende gassen die zich in dezelfde temperatuur- en drukomstandigheden bevinden, hetzelfde aantal gasvormige deeltjes bevatten.
Dit betekent dat, als we twee ballonnen hebben, één vol met helium en de andere met zuurstof, en beide ballonnen hetzelfde volume hebben, dezelfde druk en dezelfde temperatuur, dan zal er hetzelfde aantal gasvormige heliumatomen in de eerste zijn bol die zuurstofmoleculen in de tweede.
Avogadro Law -formule
Een andere manier om de wet van Avogadro te vermelden, is door te zeggen dat, als constante druk en temperatuur worden gehandhaafd, het volume van een gas evenredig zal zijn met het aantal mollen. Dit wordt op een wiskundige manier weergegeven als:
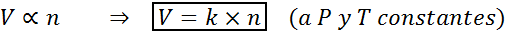
Deze formule kan worden herschikt tot v/n = k, dat wil zeggen dat de relatie tussen het volume en het aantal mol constant blijft wanneer p en t constant zijn.
Dus als we een bepaalde hoeveelheid gas uit een container introduceren of verwijderen die P en T constant houdt, zal het volume veranderen en wordt de initiële en uiteindelijke status gerelateerd door middel van de volgende vergelijking:

Voorwaarden waaronder de wet van Avogadro wordt voldaan
Deze wet is precies van toepassing op ideale gassen. Dit zijn gassen gevormd door specifieke deeltjes (die geen volume in de ruimte bezetten) die op geen enkele manier met elkaar communiceren.
Het kan u van dienst zijn: Biodiesel: geschiedenis, eigenschappen, typen, voor-, nadelenZoals de naam al aangeeft, bestaat dit type gase niet in de realiteit maar in onze verbeelding. Ze zijn een vereenvoudigd "idee" van wat we geloven dat een gas is. Er zijn echter enkele voorwaarden waaronder een echt gas, zoals lucht, zich idealiter gedraagt: bij zeer lage drukken en bij zeer hoge temperaturen.
De lage drukken ervoor zorgen dat het volume dat door de gasdeeltjes wordt bezet, te verwaarlozen is in vergelijking met de grootte van de container, terwijl de hoge temperaturen de deeltjes zo snel laten bewegen dat ze geen tijd hebben om te communiceren wanneer ze met elkaar oversteken.
Onder deze omstandigheden voldoen de meeste gassen met een goede nauwkeurigheid van Avogadro aan.
Het belang van de wet van Avogadro
Een van de belangrijkste bijdragen van de wet van Avogadro was dat het het bestaan van elementaire gassen vormde gevormd door meer dan één atoom als de O2 of h2. Dit heeft bijgedragen aan de opmars van de atomaire theorie.
Bovendien vormt de wet van Avogadro de wetten van Boyle, Charles en Gay-Lussac, en het combineren met deze drie wetten, staat de wet van Avogadro de wet van ideale gassen toe, een van de belangrijkste wetten in de chemie.
Aan de andere kant maakt de wet van Avogadro ook het mogelijk om relaties aan te gaan tussen molecuulgewichten van verschillende gassen, omdat het impliceert dat de massa van gelijke volumes van verschillende gassen gemeten bij dezelfde temperatuur en druk, evenredig is met de massa van elk deeltje van elk gas.
Kan u van dienst zijn: natriumnitraat (nano3): structuur, eigenschappen, gebruik, risico'sDus met enkele spijt -monsters van twee gassen die volumes bezetten die gelijk zijn aan dezelfde temperatuur en druk, kan de relatie tussen de molaire massa's worden verkregen.
Voorbeelden van de wet van Avogadro in het dagelijks leven
Feestballonnen
We hebben ooit een clown gezien bij een kinderpartij dat heliumballonnen opblaast om ze onder de kinderen te verspreiden. Deze ballonnen zijn op ongeveer dezelfde temperatuur. Als twee partijballonnen op dezelfde druk worden gevuld en beide even groot zijn, zorgt de wet van Avogadro ervoor dat beide ballonnen hetzelfde aantal heliummolken hebben.
Aan de andere kant, als een van de ballonnen groter is dan de andere, zal het een groter volume hebben en volgens de wet van Avogadro zal het een grotere hoeveelheid heliumdeeltjes binnen hebben.
De banden van een auto
Ongeacht welk gas ze worden gevuld, de banden aan de tegenovergestelde zijden van een auto zijn altijd gevuld met dezelfde uiteindelijke druk van ongeveer 32 psi.
Bovendien zorgen we er altijd voor dat beide rubbers hetzelfde zijn, zodat ze hetzelfde volume hebben. Volgens het Avogadro -principe kunnen we dus zeggen dat beide banden hetzelfde aantal gasvormige deeltjes zullen bevatten.
Een spuit vol lucht
Stel dat we een open spuit hebben en vol 50 cm3 van de lucht. Zoals open is, zijn het interieur van de spuit en de buitenkant (de omgeving) op dezelfde temperatuur en druk.
Stel nu dat we op de spuitplunjer drukken en verplaatsen tot 10 cm worden gelezen3. Terwijl de spuit wordt ontdekt, ontsnapt de lucht door de punt terwijl de plunjer beweegt, dus het aantal luchtdeeltjes in de spuit neemt samen met het volume af met het volume.
Kan u van dienst zijn: vervluchtigingAangezien de druk noch de temperatuur veranderen, kan de Avogadro -wet worden toegepast om het uiteindelijke volume te relateren aan de hoeveelheid luchtdeeltjes die in de spuit blijven. Deze relatie is:

Als we deze vergelijking herschikken, krijgen we dat:
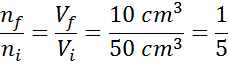
Dit resultaat betekent dat, als we het volume binnen de spuit tot de vijfde verminderen, P en T constant houden, het aantal mol of deeltjes binnen het einde van het proces ook het vijfde deel zal zijn van wat oorspronkelijk had.


