LDH -functies, bepaling, reactie, normale waarden
- 4357
- 1087
- Irving McClure I
De lactaatdehydrogenase, Melkzuurdehydrogenase, lactaat NAD-afhankelijke afhankelijke afhankelijke afhankelijke of eenvoudig LDH, is een enzym dat behoort tot de oxidorticasgroep die praktisch wordt aangetroffen in alle dierlijke weefsels, groenten en in veel micro-organismen zoals bacteriën, gisten en bogen.
Enzymen van dit type worden aangeduid met nummer EC 1.1.1.27 van het enzymatische nomenclatuurcomité en zijn verantwoordelijk voor de reactie die lactaat omzet tot pyruvaat (door oxidatie) en vice versa (door reductie), oxideren of reduceren.
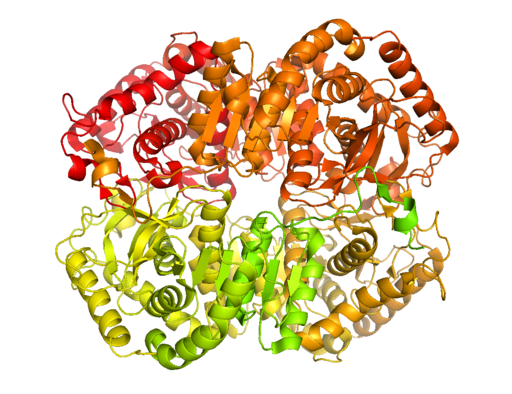
 Kristallijne structuur van lactaatdehydrogenase B (Bron: BCDoye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Kristallijne structuur van lactaatdehydrogenase B (Bron: BCDoye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) In tegenstelling tot alcoholische gisting, die alleen voorkomt bij sommige micro -organismen zoals gisten en gebruik.
Dit belangrijke enzym voor celmetabolisme werd gekristalliseerd door skeletrattenspier in de jaren 1940 en tot op heden het best gekenmerkt zijn dat van skeletspier en het hartweefsel bij zoogdieren.
Bij "superieure" dieren gebruikt het enzym het lactaat L-isomeer (L-lactaat) voor de productie van pyruvaat, maar sommige "lagere" dieren en bacteriën produceren D-lactaat uit het pyruvaat verkregen door glycolyse.
Lactaatdehydrogenase wordt meestal meestal tot expressie gebracht in weefsels of cellen onder anaërobe omstandigheden (irrigatie met lage bloed) die bijvoorbeeld bij mensen pathologische aandoeningen kunnen karakteriseren zoals kanker, lever of hartaandoeningen.
De omzetting van het pyruvaat in lactaat is echter typerend voor de spieren tijdens de oefening en het hoornvlies van het oog, dat slecht geoxygeneerd is.
[TOC]
Functie
Lactaatdehydrogenase voldoet aan meerdere functies op tal van metabole routes. Het is het centrum van de delicate balans tussen de katabole en anabole routes van de koolhydraten.
Tijdens aerobe glycolyse, pyruvaat (het laatste product van de route per se) Het kan worden gebruikt als een substraat van het enzymatische complexe pyruvaatdehydrogenase, door wie het is gedecarboxyleerd, waarbij acetyl-CoA-moleculen worden gebruikt die stroomafwaarts worden gebruikt, metabolisch gesproken, in de Krebs-cyclus.
In anaërobe glycolyse produceert de laatste stap van glycolyse integendeel pyruvaat, maar dit wordt gebruikt door lactaatdehydrogenase om lactaat en NAD te produceren+, Dat herstelt de NAD+ die werd gebruikt tijdens de reactie gekatalyseerd door glyceraldehyde 3-fosfaatdehydrogenase.
Aangezien tijdens anaerobiose de belangrijkste bron van energieproductie in de vorm van ATP glycolyse is, speelt lactaatdehydrogenase een fundamentele rol bij de reoxidatie van de NADH die wordt geproduceerd in eerdere stappen van de glycolytische route, essentieel voor de werking van andere gerelateerde enzymen.
Kan u van dienst zijn: tubulinLactaatdehydrogenase is ook betrokken bij glycogenese die plaatsvindt in weefsels die lactaat omzetten in glycogeen en, in sommige aerobe weefsels zoals het hart, is lactaat een brandstof die wordt geroxd om energie te produceren en het vermogen te verminderen in de vorm van ATP en NAD+, respectievelijk.
Kenmerken en structuur
Er zijn meerdere moleculaire vormen van lactaatdehydrogenase in de natuur. Alleen bij dieren is vastgesteld dat er vijf activiteiten lactaatdehydrogenase zijn, alle tetramere en in wezen samengesteld uit twee soorten polypeptideketens die bekend staan als de subuniteiten h en m (in staat zijn homo- of heterotramérica te zijn).
De H -vorm bevindt zich meestal in hartstof, terwijl de M -vorm is gedetecteerd in skeletspier. Beide ketens verschillen van elkaar in termen van overvloed, aminozuursamenstelling, kinetische eigenschappen en structurele eigenschappen.
H- en M -vormen zijn het translatieproduct van verschillende genen, mogelijk in verschillende chromosomen, en die ook onder de controle of regulatie van verschillende genen staan. De H -vorm is overheersend in weefsels met aerobe metabolisme en de M -vorm in anaërobe weefsels.
Een ander type nomenclatuur gebruikt letters A, B en C voor de verschillende soorten enzymen in zowel zoogdieren als vogels. Aldus staat lactaatspierdehydrogenase bekend als4, hart als B4 en een derde wordt C genoemd4, die specifiek is voor de testikels.
De expressie van deze isoenzymen wordt zowel in een vorm van ontwikkelingsafhankelijk als weefselafhankelijk gereguleerd.
Het enzym is geïsoleerd uit verschillende dierenbronnen en er is vastgesteld dat de tetramere structuur een gemiddeld molecuulgewicht van ongeveer 140 kDa heeft en dat de vakbondslocatie voor NADH of NAD+ Het bestaat uit een β-peeled blad bestaande uit zes ketens en 4 alfa propellers.
Bepaling
Door spectrofotometrie
Lactaatactiviteit dehydrogenase van dierlijke oorsprong is zeker spectrofotometrisch In vitro door kleurveranderingsmetingen dankzij het oxidorreductieproces dat plaatsvindt tijdens de lactaatpyruvaatconversiereactie.
De metingen worden uitgevoerd bij 340 nm met een spectrofotometer en de snelheid van afname van de optische dichtheid als gevolg van oxidatie of "verdwijning" van NADH wordt bepaald, die wordt omgezet in NAD+.
Dat wil zeggen, de vastberaden reactie is als volgt:
Pyruvate + NADH + H+ → lactaat + NAD+
De enzymatische meting moet worden uitgevoerd in optimale pH -omstandigheden en concentratie van substraten voor het enzym, zodat het risico op het onderschatten van de aanwezige hoeveelheid in de monsters als gevolg van substraattekort of door extreme omstandigheden van zuurgraad of basiciteit niet loopt.
Door immunohistochemie
Een andere methode, misschien iets moderner, voor de bepaling van de aanwezigheid van lactaatdehydrogenase heeft te maken met het gebruik van immunologische hulpmiddelen, dat wil zeggen met het gebruik van antilichamen.
Kan u dienen: Homologie (biologie)Deze methoden maken gebruik van de affiniteit tussen de vereniging van een antigeen met een antilichaam dat speciaal ertegen is gegenereerd en zijn zeer nuttig voor de snelle bepaling van de aanwezigheid of afwezigheid van enzymen zoals LDH in een bepaald weefsel.
Afhankelijk van het doel moeten de gebruikte antilichamen specifiek zijn voor de detectie van een van de isoenzymen of voor elk eiwit met lactaatactiviteit dehydrogenase.
Waarom dehydrogenase lactaat bepalen?
De bepaling van dit enzym wordt uitgevoerd met verschillende doeleinden, maar voornamelijk voor de klinische diagnose van sommige aandoeningen, waaronder myocardinfarct en kanker.
Op cellulair niveau is de afgifte van dehydrogenase -lactaat beschouwd als een van de parameters om het optreden van necrotische of apoptotische processen te bepalen, omdat het plasmamembraan permeabel wordt.
De producten van de reactie die katalyz kan worden bepaald in een weefsel om te bepalen of een anaërobe metabolisme overheerst om een speciale reden.
Reactie
Zoals aanvankelijk opgemerkt, is het enzymlactaatdehydrogenase, waarvan de systematische naam is (S) -Lactato: NAD+ dehydrogenase, katalyz lactaatconversie in een pyruvaat+ afhankelijk, of vice versa, die plaatsvindt dankzij de overdracht van een hydride -ion (h-) Van het pyruvaat tot lactaat of van NADH tot geoxideerd pyruvaat.
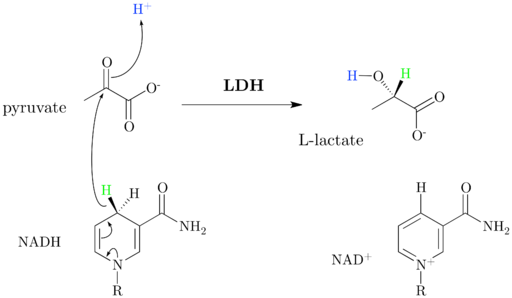 Schema en reactiemechanisme van dehydrogenase lactaat (Bron: Jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Schema en reactiemechanisme van dehydrogenase lactaat (Bron: Jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) De NAD+ Het heeft een ADP -eenheid en een andere nucleotische groep afgeleid van nicotinezuur, ook wel niacine of vitamine B genoemd3, En dit co -enzym neemt deel aan meerdere reacties van groot biologisch belang.
Het is belangrijk om te benadrukken dat de balans in deze reactie wordt verplaatst naar de zijde die overeenkomt met het lactaat en is aangetoond dat het enzym ook andere zuren kan oxideren (S) -2 -hydroximonocarbonylic en gebruik, hoewel minder efficiënt, NADP+ als een substraat.
Afhankelijk van het lichaamsgebied dat wordt overwogen en tegelijkertijd zijn metabole kenmerken in relatie tot de aanwezigheid of afwezigheid van zuurstof, produceren de weefsels verschillende hoeveelheden lactaat, het product van de reactie gekatalyseerd door de LDH.
Als bijvoorbeeld een rode bloedcel (erytrocyt) die mitochondriën mist die het tijdens glycolyse geproduceerde pyruvaat kan metaboliseren2 En water, dan kan worden gezegd dat dit de belangrijkste lactaatproducerende cellen in het menselijk lichaam zijn, omdat al het pyruvaat wordt omgezet in lactaat door de werking van het dehydrogenase -lactaat.
Aan de andere kant, als de levercellen en cellen van de skeletspier worden overwogen, zijn deze verantwoordelijk voor de productie van een minimale hoeveelheid lactaat, gezien het feit dat dit snel wordt gemetaboliseerd.
Kan u van dienst zijn: Sabouraud Agar: wat is, fundering, voorbereiding, gebruikNormale waarden
De concentratie van lactaatdehydrogenase in bloedserum is het product van de expressie van verschillende isoenzymen in de lever, hart, skeletspier, erytrocyten en tumoren, onder andere.
In het bloedserum liggen de normale activiteiten van het dehydrogenase -lactaat tussen 260 en 850 u/ml (eenheden per milliliter), met een gemiddelde waarde van 470 ± 130 U/ml. Ondertussen hebben bloed hemoraliseerde een LDH -activiteit die varieert tussen 16.000 en 67.000 U/ml, wat overeenkomt met een gemiddelde van 34.000 ± 12.000 U/ml.
Wat betekent het om een hoge LDH te hebben?
De kwantificering van de concentratie van lactaatdehydrogenase in het bloedserum heeft een belangrijke waarde bij de diagnose van sommige hart, lever, bloedziekten en zelfs kankers.
Hoge LDH -activiteitscijfers zijn gevonden bij patiënten met myocardinfarcten (zowel experimenteel als klinisch), evenals bij kankerpatiënten, met name bij vrouwen met endometriumkanker, eierstokken, borst en baarmoeder.
Afhankelijk van het specifieke isoenzym dat zich in een "overmaat" of in een hoge concentratie bevindt, wordt de kwantificering van de isoenzymen van het dehydrogenase -lactaat gebruikt door velen die artsen behandelen voor de bepaling van verwondingen aan de weefsels (ernstig of chronisch).
Referenties
- Bergmeyer, h., Gebogen, e., & Hess, b. (1961). Lactische dehydrogenase. Methoden van enzymatische analyse. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Genomische organisatie van menselijk lactaat dehydrogenase-A-gen. Journal Biochemical, 231, 537-541.
- Becker, D. (2003). Melkzuur. Intensive care med, 29, 699-702.
- Zelfs J., & Kaplan, n. (1973). Lactaat dehydrogenses: structuur en functie. In Vooruitgang in enzymologie en gerelateerde gebieden van moleculaire biologie (PP. 61-133).
- Fox, s. Je. (2006). Menselijke fysiologie (9e ed.)). New York, VS: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, P. M. M. (1997). De klinische waarde van lactaatdehydrogenase in serum: een kwantitatieve review. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IBMB). (2019). Opgehaald van www.Qmul.AC.Uk/sbcs/iubmb/enzym/index.HTML
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-gomez, m., Wicks, r. W., & Warshaw, m. (1979). Immunochemische bepaling van het hart isoenzyme van lactaatdehydrogenase (LDH1) in menselijk serum. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, j. S. (1955). Lactische DeGydrogenase -activiteit in bloed. Experimentele biologie en geneeskunde, 90, 210-215.
- « Páramo -kenmerken, types, flora, fauna, voorbeelden
- Apolipoproteïne en kenmerken, functies, ziekten »

