Laminina -kenmerken, structuur, functies, typen
- 3677
- 975
- Cecil Graham
De Laminine Het is een van de eiwitten die de extracellulaire matrix vormt van het basale membraan van epitheliale weefsels in gewervelde dieren. Dit type eiwit biedt een bindende ondersteuning tussen conjunctieve weefselcellen, zodat ze werken in de cohesie en verdichting hiervan.
Over het algemeen zijn laminines verantwoordelijk voor het bestellen van het ingewikkelde eiwitnetwerk dat de extracellulaire matrix of basaal weefselmembraan vormt. Typisch worden laminines geassocieerd met eiwitten zoals collageen, proteoglycans, entactines en hepar zullen sulfaat.
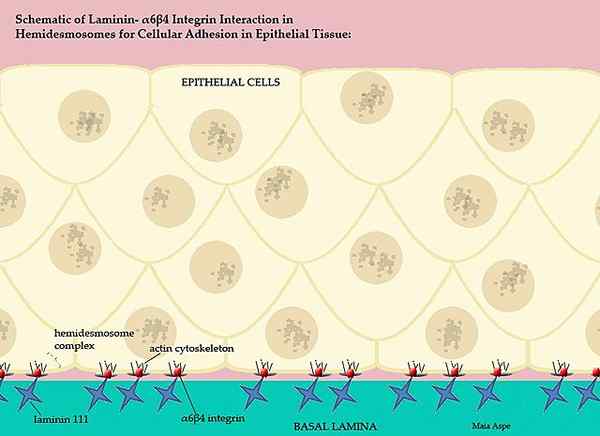
 Laminines en hun deelname aan het basale gewervelde membraan (bron: maiaaspe/cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons)
Laminines en hun deelname aan het basale gewervelde membraan (bron: maiaaspe/cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons) Dit ingewikkelde basale membraan, geordend door de laminines, scheidt de epitheliale delen van de weefsels, dat wil zeggen dat elke extracellulaire matrix het endotheel scheidt van de mesototio en de extracellulaire matrix van de mesotelito scheidt deze laag van het epitheel.
Veel onderzoeken hebben aangetoond dat de expressie van gemuteerde laminines -genen potentieel dodelijk is voor een cel, omdat deze ook verantwoordelijk zijn voor het reguleren van bijna alle complexe interacties die optreden in het basale membraan.
Er is een grote diversiteit aan lamininesfamilies in alle gewervelde dieren. Deze variëren in samenstelling, vorm, functie en oorsprong. In hetzelfde individu kunnen in verschillende weefsels verschillende laminines worden gevonden, elk aangepast aan de omgeving van het weefsel dat het uitdrukt.
[TOC]
Laminina -kenmerken
Laminine -monomeren of eenheden bestaan uit een ander heterotromer van een glycoproteïne -ketens. Deze eiwitten bevatten veel verschillende domeinen (multidominiums) en vormen een essentieel onderdeel van de vroege embryonale ontwikkeling van weefsels.
De gemeenschappelijke vorm van laminines is een soort "kruis" of "y", hoewel sommige een lange balkvorm hebben met vier vertakkingen. Door deze kleine variatie kan elk type laminine regelmatig de adequate integratie vanuit elke positie in het weefsel.
Het kan u van dienst zijn: P-nitrofenol: kenmerken, gebruik en toxiciteitLaminines hebben een hoog molecuulgewicht, dat kan variëren afhankelijk van het type laminine, van 140 tot 1000 kDa.
Over het algemeen heeft elk basaal membraan een of verschillende soorten laminines binnen en sommige wetenschappers stellen voor dat laminines een groot deel van de fysiologische functie van de basale membranen van het weefsel bepalen waar ze worden gevonden.
Bij gewervelde dieren zijn ten minste 15 verschillende soorten laminines gevonden, geclassificeerd in een gezin, omdat ze worden gevormd uit dezelfde trimmer, maar met verschillende combinaties. In ongewervelde dieren hebben ze tussen 1 en 2 verschillende trimeren gevonden.
Huidige studies suggereren dat laminines van alle gewervelde dieren ontstaan door de differentiatie van orthologen, dat wil zeggen alle genen die voor laminines coderen, een gemeenschappelijke oorsprong hebben van ongewervelde dieren.
Structuur
Ondanks het grote aantal functies die laminines reguleren, hebben ze een vrij eenvoudige structuur die voor het grootste deel wordt bewaard bij de verschillende typen die bekend zijn.
Elk laminine bestaat uit drie verschillende ketens die met elkaar verweven zijn die een soort "verweven vezel" vormen. Elk van de drie ketens wordt geïdentificeerd als ALFA (α), bèta (β) en gamma (γ).
De vorming van het trimeer van elk laminine hangt af van de vereniging van het C-terminale gebied van elk van zijn ketens. In elk molecuul worden deze ketens gekoppeld door peptidekoppelingen en drie disulfidebruggen die de structuur een grote mechanische weerstand geven.
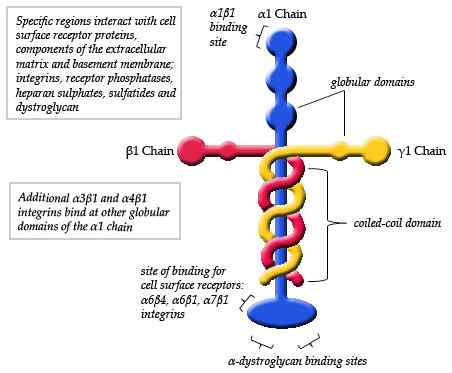 Schematisch diagram van de structuur van een laminine (bron: maiaaspe/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons)
Schematisch diagram van de structuur van een laminine (bron: maiaaspe/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons) De waarnemingen van elektronische microscopie van de typische laminine -monomeren hebben gedetailleerd dat de structuur een soort asymmetrisch kruis is met een lange arm van ongeveer 77 nm (nanometers) die wordt gekenmerkt door een prominente bolvormige vorm aan een van de uiteinden.
Kan u van dienst zijn: populatiedynamiekBovendien worden drie korte armen waargenomen, twee van ongeveer 34 nm en een van ongeveer 48 nm. Elke arm eindigt aan één bolvormig uiteinde, vergelijkbaar met de hoofdketen, maar kleiner in grootte.
Het verschil tussen de verschillende soorten laminines is voornamelijk te wijten aan verschillen in α -ketens, die op ten minste drie verschillende manieren kunnen worden gevouwen; Hoewel momenteel variaties voor alle ketens zijn geïdentificeerd:
- 5 verschillende variaties of ketens van laminine α
- 3 variaties van β -ketens
- 3 variaties voor γ -ketens
Functie
De belangrijkste en meest bestudeerde functie van laminines is die van interactie met de receptoren die verankerd zijn in de celmembranen van de cellen grenzend aan de basale membranen waar deze worden gevonden.
Door deze interactie wordt deze eiwitten betrokken bij de regulatie van meerdere cellulaire activiteiten en signaalroutes. Het is te wijten dat hun functies afhankelijk zijn van hun interactie met specifieke receptoren op het celoppervlak (veel van de membraanreceptoren zijn momenteel geclassificeerd volgens hun vermogen om laminines te verenigen).
Integrines zijn de receptoren die interageren met de "niet -integrine" laminines en receptoren zijn die die niet in staat zijn zich bij deze eiwitten aan te sluiten. De meeste "niet -integrine" -receptoren zijn proteoglycanen, sommige dystroglycans of syndecanos.
De rijping van de weefsels van de lichaamsorganen vindt plaats met een vervanging van vroege laminines, die aanvankelijk werden ondergebracht in het basale membraan van de weefsels die de jeugdorganen vormden.
Binnen de laminines is het type dat het meest is bestudeerd laminine-1, dat direct is gekoppeld aan de groei van axonen van vrijwel elk type neuron in omstandigheden In vitro, Omdat ze de beweging van de "groeicegel" op het oppervlak van de neuronen reguleren.
Kan u van dienst zijn: ureumbouillon: wat is, fundering, voorbereiding, gebruikNomenclatuur en typen
Biochemisten beschouwen de familie van laminines als een zeer grote familie van eiwitten, waarvan maar weinig leden nog steeds bekend zijn. Met moderne tools kunnen echter nieuwe soorten laminines een glimp worden bekeken.
Dergelijke eiwitten worden elk geïdentificeerd met een getal, beginnend met 1 eindigend de nummering in 15 (laminine-1, laminine-2 ... laminina-15).
Een ander type nomenclatuur wordt ook gebruikt, wat aangeeft welk type ketting dat elk laminine heeft. Laminine -11 bestaat bijvoorbeeld uit een ALFA (α) -5 -keten, door een bèta -keten (β) -2 en door een gamma -keten (γ) -1, dus het kan Laminina -521 worden genoemd.
Bovendien wordt elk laminine geclassificeerd volgens de functie die wordt geassocieerd waarmee het is geassocieerd en ook volgens het specifieke lichaamsweefsel waaraan het deelneemt. Enkele voorbeelden van laminines zijn:
- Lamina-1: die deelneemt aan epitheliale ontwikkeling
- Laminina-2: betrokken bij de myogene ontwikkeling van alle weefsels, het perifere zenuwstelsel en de glomerulusmatrix.
- Lamina-3: Deelnemen aan mijn-tendinale vakbonden
- Lamina-4: Werkt in neuromusculaire vakbonden en in de mesangiale matrix van Glomeruli
- Laminina-5, 6 en 7: ze werken bij voorkeur in epidermale weefsels.
Referenties
- Miner, J. H., & Yurchenco, p. D. (2004). Laminine functies in weefselmorfogenese. Annu. Revisie. Cel dev. Biol., 20, 255-284.
- Rasmussen, D. G. K., & Karsdal, m. NAAR. (2016). Laminines. In biochemie van collagenen, laminines en elastine (PP. 163-196). Academische pers.
- Sasaki, T., Fässler, r., & Hohenester, en. (2004). Laminine: de kern van basaalmembraanassemblage. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, g. R. (1983). Multifunctioneel laminine-A-eiwit van basaalmembranen. Trends in Biochemical Sciences, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, p. G., Rennard, s. Je., Foidart, J. M., & Martin, g. R. (1979). Laminine-a glycoproteïne uit basale membranen. Journal of Biological Chemistry, 254 (19), 9933-9937.
- TRYGGVASON, K. (1993). De Laminin -familie. Huidige mening in Cell Biology, 5 (5), 877-882.

