Adsorptie isothermen concept, typen, voorbeelden

- 945
- 137
- Miss Herman Russel
De Adsorptie -isothermen Het zijn grafische representaties van het gedrag van een geadsorbeerd deeltje, op het oppervlak van een vaste of vloeistof, wanneer de concentratie ervan wordt verhoogd. Als de geadsorbeerde deeltjes overeenkomen met die van een gas, dan wordt de druk in aanmerking genomen.
Door deze isotherm te observeren, kan een idee worden genomen van hoe het adsorptieproces plaatsvindt; En daarom, hoe zijn deeltjesoppervlak interacties en oppervlakte-eigenschappen. Analyseren van de isotherm wordt afgeleid als het oppervlak soepel, poreus of microporeus is, evenals mogelijke condensaties.
 Componenten die nodig zijn voor de grafiek of constructie van adsorptie -isothermen. Bron: Gabriel Bolívar.
Componenten die nodig zijn voor de grafiek of constructie van adsorptie -isothermen. Bron: Gabriel Bolívar. Het superieure beeld helpt om de bovengenoemde te verduidelijken. De geadsorbeerde deeltjes (paarse cirkels) zijn de zo -aangedane adsorbaten. Terwijl het adsorbens is degene die een gebied heeft waarop de adsorbaten worden geadsorbeerd. Naarmate uw druk of concentratie toeneemt, hoe groter het geadsorbeerde volume over het adsorbens.
Deze eenvoudige weergave komt overeen met een adsorptie beschreven door Type I isotherm. Het gebruik van isothermen, adsorptie van gassen of vloeibare oneindigheden op gels, vaste stoffen of katalysatoren worden bestudeerd.
[TOC]
Soorten adsorptie -isothermen
 Adsorptie-isothermen voor gasoplossende systemen. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Adsorptie-isothermen voor gasoplossende systemen. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) Vijf van de belangrijkste experimentele isothermen die door S worden gebruikt, worden hierboven weergegeven. Brunauer om gasvormige deeltjes op vaste stoffen te classificeren. Elk beschrijft een ander adsorptieproces. Ook heeft elk wiskundige modellen die proberen het gedrag van zijn curven af te leiden.
Onstijgen van wat de eenheden of de variabelen zijn die worden gebruikt in de x (p/po) en y (x) assen, geeft de x -as aan hoeveel druk of conversie van adsorbaat "handelingen" op de vaste stof; Terwijl de y -as zegt hoeveel van dat adsorbaat echt was geadsorbeerd op het oppervlak van genoemde vaste of adsorbens.
Het kan u van dienst zijn: kopersulfaat (CUSO4): structuur, eigenschappen, verkrijgen, gebruikDus, terwijl we rechts van de X -as gaan, zien we hoe de hoeveelheid geadsorbeerde deeltjes toeneemt, afhankelijk van de toename van hun druk of concentraties. Dit leidt tot een maximum, een verval, een vallei, enz., Dat staat op de een of andere manier toe om te interpreteren hoe adsorptie plaatsvindt.
Type I isotherm
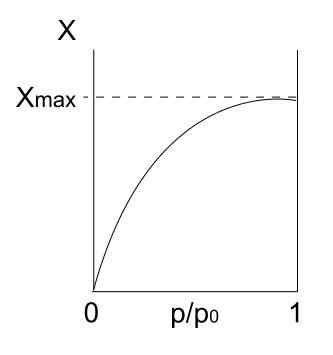 Type I isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Type I isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) We hebben het type I isotherm hierboven, dat ook bekend staat als Langmuir -isotherm, omdat het model de vorm van deze curve voorspelde. Als je het ziet, wordt het onmiddellijk geïnterpreteerd dat er een maximale hoeveelheid (xmax) van geadsorbeerde deeltjes is, die niet zullen variëren.
Deze maximale adsorptiewaarde kan te wijten zijn aan verschillende redenen. Een van hen is dat er een chemisorctie plaatsvindt, wat betekent dat deeltjes of adsorbaten sterk gebonden zijn aan het oppervlak van de vaste stof of adsorbens. Zodra er geen ruimte meer op het oppervlak is om meer deeltjes te huisvesten, zal er geen adsorptie meer zijn.
Er wordt dan gezegd dat een monolaag zich heeft gevormd (zoals de paarse cirkels van de eerste afbeelding).
Een andere reden om Type I-isotherm te rechtvaardigen is dat een fisisorptie optreedt, wat betekent dat interacties van deeltjesoppervlak erg zwak zijn (ze impliceren geen vorming van chemische bindingen).
In dit geval komen de deeltjes uiteindelijk in microporo's, die eenmaal gevuld, het oppervlak niet meer plaatsen heeft voor de volgende adsorcties; Dat wil zeggen, het heeft weinig extern gebied beschikbaar (alsof het een heel fijn rooster is). Dit gedrag wordt waargenomen wanneer microporeuze poeders worden geanalyseerd.
Kan u van dienst zijn: silicium: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikType isotherm II
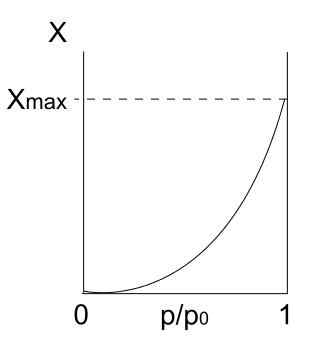
 Type II isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Type II isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) We hebben Type II isotherm, ook bekend als sigmoid isotherm. Dit beschrijft Physis -processen voor zowel niet -porale vaste stoffen als macroporeuze vaste stoffen.
Merk op dat het in het begin lijkt op de vorige isotherm, wat betekent dat de geadsorbeerde deeltjes een monolaag vormen op het adsorbensoppervlak. Zodra de monolaag klaar is, zullen de andere deeltjes bovenop de eerste worden geadsorbeerd, wat aanleiding geeft tot meerdere lagen. Dit is wanneer we de karakteristieke toename van deze isotherm (rechts) zien.
Een andere reden waarom isotherm van type II wordt verkregen, is omdat de deeltjes een grotere affiniteit voor het oppervlak voelen dan zichzelf. Dat wil zeggen, de monolaag (deeltjes-superficie) zal later stabieler en duurzamer zijn dan de meerlagige lagen (deeltjes-delen).
Type isotherm III
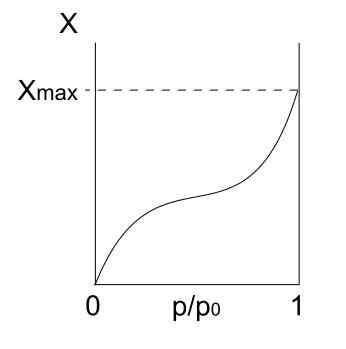
 Type III isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Type III isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) Type III isotherm is vergelijkbaar met Type II met betrekking tot de interpretatie ervan: multicapas en Physis. Deze keer zijn de interacties tussen multicapas echter sterker dan die van de monolaag met het oppervlak van de vaste stof. Daarom is het een onregelmatige adsorptie, met terpen geadsorbeerde deeltjes en vrije oppervlakte -onderdelen.
Type isotherm Iv
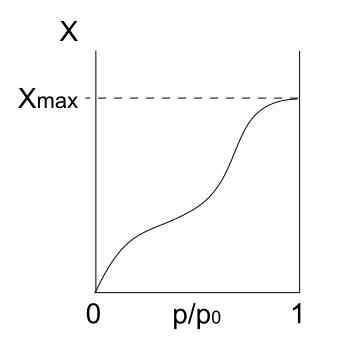 Type IV isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Type IV isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) Type IV isotherm beschrijft ook fisisorptie- en meerlagige processen, die eruit zien als type II isotherm; Maar nu, in poreuze (en mesoporeuze) vaste stoffen, waarbij de condensatie van gasvormige deeltjes mogelijk is in kleine vloeibare volumes. Totdat de porie met vloeistof "bedekt" is, is de monolaag niet voltooid.
Kan u van dienst zijn: Food Chemistry: Study of Study, Elements, ApplicationsType isotherm V
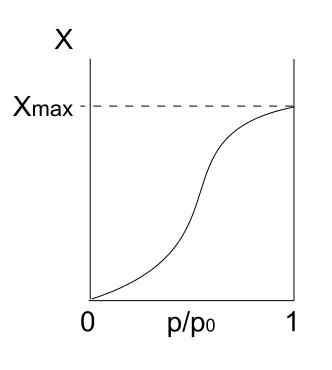 Type V isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)
Type V isotherm. Bron: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0) Type V isotherm is vergelijkbaar met type IV, alleen deze keer zijn de formaties van multicapas vatbaarder dan de respectieve mono -forpa. Dat wil zeggen, het lijkt op de adsorptie beschreven door Type III isotherm. Hier bereikt multicapa een maximale dikte, waar er geen plaatsen zijn voor meer deeltjes voor adsorb.
Voorbeelden
Enkele voorbeelden van gas-vaste systemen worden hieronder vermeld naast het type isothermen dat in hun experimentele studies zijn verkregen:
-Ammoniak-carbon (Type I)
-Stikstof-zeolieten (type I)
-Waterstof-koolstof bij hoge temperaturen (type I)
-Coal Oxygen-Negro (Type I)
-Silica stikstof (type II)
-Stikstof-hierro (type II)
-Silica bromo-gel (type III)
-Silica jodiumdamp (type III)
-Stikstof-politiek (type III)
-Kripton-neger van Coal (Type IV)
-Benzeen-gel van ijzeroxide (type IV)
-Waterdamp-koolstof (type V)
Merk op dat de genoemde vaste stoffen steenkool, zwarte steenkool, metalen ijzer, ijzeroxide, zeolieten en silicagel waren. Ze zijn allemaal goede voorbeelden van adsorbentia met verschillende industriële toepassingen.
Referenties
- Walter J. Moore. (1963). Fysische chemie. In thermodynamica en chemische balans. (Vierde ed.)). Longmans.
- Iran. Levine. (2009). Principes van fysicochemie. Zesde editie, pagina 479-540. MC Graw Hill.
- Glasstone. (1970). Leerboek van fysische chemie. Tweede druk. D. Van Nostrand, Company, Inc.
- Hoofdstuk 3. Oppervlakte -fenomenen. (S.F.)). Adsorptie. [PDF]. Hersteld van: depa.Fquim.UNAM.mx
- Lowell s., Shields J.EN. (1984) Adsorptie -isothermen. In: poederoppervlak en porositeit. Springer, Dordrecht.
- Elsevier B.V. (2020). Adsorptie isotherm. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Wikipedia. (2020). Adsorptie. Opgehaald uit: in.Wikipedia.borg
- « Afdelingen van de Pacifische regio Colombia
- Waar is de telescoop voor? Het 3 belangrijkste gebruik »

