Isóbaros
- 4029
- 446
- Hugo Crooks
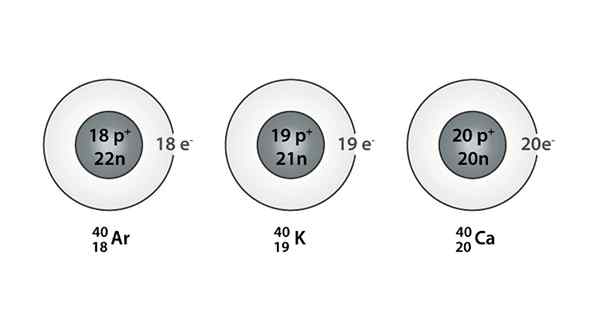
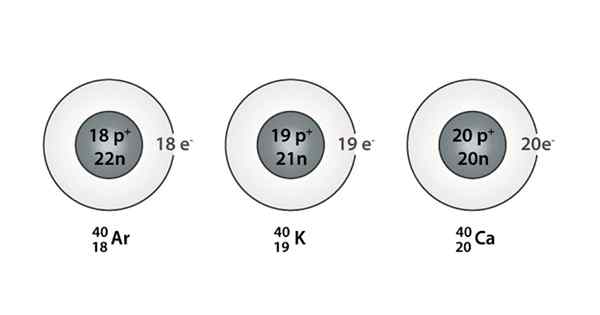 Voorbeeld van Isóbaro; Argon, kalium en calcium, die atomen van dezelfde massa hebben (40)
Voorbeeld van Isóbaro; Argon, kalium en calcium, die atomen van dezelfde massa hebben (40) Wat zijn de isoparos?
De Isóbaros Het zijn die atomaire soorten die dezelfde massa hebben, maar die afkomstig zijn van verschillende chemische elementen. Als gevolg hiervan kan worden gezegd dat ze worden gevormd door verschillende aantallen protonen en neutronen.
Zowel protonen als neutronen zijn in de kern van hun atomen, maar de netto hoeveelheid neutronen en protonen die in elke kern aanwezig zijn, blijft hetzelfde. Met andere woorden, een Isóbara -soort is ontstaan wanneer een paar atoomkernen hetzelfde netto neutronen en protonen voor elke soort vertoont.
Het aantal neutronen en protonen dat dat netto bedrag is, is echter anders. Een manier om het op te merken is om het massacijfer te observeren (dat aan de linkerbovenkant van het symbool van het chemische element wordt geplaatst dat wordt weergegeven), omdat dit nummer in de isopieën hetzelfde is.
De etymologie van de Isóbaro -term komt van Griekse woorden ISO's (wat "hetzelfde" betekent) en Baros (wat "gewicht" betekent), wat verwijst naar de gelijkheid van gewichten tussen beide nucleaire soorten.
Kenmerken van de isoparos
- De isoparo's houden bepaalde overeenkomsten bij met andere soorten wiens kernen toevalligheden vertonen, zoals de isotone, die dezelfde hoeveelheid neutronen hebben, maar met verschillende massa- en atoomnummernummer, zoals leeftijdsgenoten 13C en 14Nee 36S en 37Klet.
- De term "nucleid" is de denominatie die is bedacht tot elk van de nuclea -sets (structuren gevormd door neutronen en protonen) die kunnen worden gevormd. Zodat de nucleïden zich mogelijk onderscheiden door hun aantal neutronen of protonen, of zelfs voor de hoeveelheid energie die de structuur van de conglomeratie bezit.
Kan u van dienst zijn: vloeibaarmaking: concept, gassen, bodem en seismisch, baanbrekend- Evenzo ontstaat er een kindkern na de β en dit proces is op zijn beurt een isopar van de vader -kern, omdat het aantal nucleonen in de kern ongewijzigd blijft, in tegenstelling tot wat er gebeurt door middel van desintegratie α.
- Het is belangrijk om te onthouden dat de verschillende Isóbaros een ander atoomnummer hebben, wat bevestigt dat ze verschillende chemische elementen zijn.
Vertegenwoordiging
Om de verschillende nucleïden aan te duiden, wordt een specifieke notatie gebruikt, die op twee manieren kan worden weergegeven: één bestaat uit het plaatsen van de naam van het chemische element gevolgd door hun massanummer, die verenigd zijn door een script. Bijvoorbeeld: stikstof-14, waarvan de kern bestaat uit zeven neutronen en zeven protonen.
De andere manier om deze soorten weer te geven, is door het symbool van het chemische element te plaatsen, voorafgegaan door een numeriek superstice dat het massagummer aangeeft dat het atoom in kwestie bezit, evenals een numeriek subscript dat het atoomnummer van de volgende manier aangeeft, :
ZNAARX
In deze uitdrukking X vertegenwoordigt het het chemische element van het betreffende atoom, a is het massa -getal (resultaat van de toevoeging tussen de hoeveelheid neutronen en protonen) en Z vertegenwoordigt het atoomnummer (gelijk aan de hoeveelheid protonen in de kern van de kern van het atoom).
Wanneer deze nucleïden worden weergegeven, wordt het atoomnummer van het atoom (z) meestal weggelaten omdat het geen relevante aanvullende gegevens verleent, dus wordt het vaak weergegeven als NAARX.
Een manier om deze notatie te tonen, is door het vorige voorbeeld te nemen (stikstof-14), dat ook wordt aangeduid als 14N. Dit is de notatie die wordt gebruikt voor de isoboos.
Kan u van dienst zijn: uitgebreide eigenschappen van materieVoorbeelden van Isóbaros
Het gebruik van de uitdrukking "isóbaros" voor soorten die bekend staan als nucleïden die hetzelfde aantal nucleonen hebben (gelijk massaal aantal) werd voorgesteld in de late jaren 1910 door de chemicus van Britse oorsprong Alfred Walter Stewart.
In deze volgorde van ideeën kan een voorbeeld van isoboos worden waargenomen in het geval van soorten 14C en 14N: Het massaummer is gelijk aan 14, dit houdt in dat het aantal protonen en neutronen in beide soorten anders is.
Inderdaad, dit koolstofatoom heeft een atoomnummer gelijk aan 6, dus in zijn structuur zijn er 6 protonen, en op zijn beurt heeft het 8 neutronen in zijn kern. Dan is uw massanummer 14 (6+8 = 14).
Van zijn kant heeft het stikstofatoom een atoomnummer gelijk aan 7, dus het bestaat uit 7 protonen, maar het heeft 7 neutronen in zijn kern. Uw massanummer is ook 14 (7+7 = 14).
Je kunt ook een serie vinden waarin alle atomen een massagummer hebben gelijk aan 40; Dit is het geval van de Isóbaros: 40AC, 40K, 40AR, 40Cl, en 40S.
Verschillen tussen isoto en isotopen
De nucleïden beschrijven de verschillende soorten atoomkernen die bestaan, volgens de hoeveelheid protonen en neutronen die ze bezitten.
Evenzo zijn tussen dit soort nucleïden de isotropo's en de isotopen, die hieronder worden onderscheiden.
In het geval van de Isóbaros, zoals eerder vermeld, hebben ze hetzelfde aantal nucleonen -dat is hetzelfde massa -nummer -waar het aantal protonen waarmee de ene soort hoger is dan de andere overeenkomt met het aantal neutronen dat zich bevindt tekort, dus het totaal is hetzelfde. Uw atoomnummer is echter anders.
Het kan u van dienst zijn: Crystalloid Solutions: Samenstelling, Typen en voorbeeldenIn deze zin komen de isopische soorten uit verschillende chemische elementen, dus bevinden ze zich in verschillende ruimtes van het periodiek systeem en hebben ze verschillende kenmerken en specifieke eigenschappen.
Aan de andere kant gebeurt het tegenovergestelde in het geval van isotopen, omdat ze hetzelfde atoomnummer hebben maar verschillende massa massa; dat wil zeggen, ze hebben hetzelfde aantal protonen, maar verschillende aantal neutronen in hun atoomkernen.
Bovendien zijn de isotopen atomaire soorten die tot dezelfde elementen behoren, dus ze bevinden zich in dezelfde ruimte in het periodiek systeem en hebben vergelijkbare kenmerken en eigenschappen.

