Indisch

- 4785
- 581
- James Dach
 Metallic Indian Piece. Bron: Hi-Res Images ofChemical Elements [CC by (https: // creativeCommons.Org/licenties/door/3.0)]
Metallic Indian Piece. Bron: Hi-Res Images ofChemical Elements [CC by (https: // creativeCommons.Org/licenties/door/3.0)] Wat is de Indiaan?
Hij Indisch Het is een metaal dat tot groep 13 van de periodiek systeem behoort en een chemisch symbool heeft in. Uw atoomnummer is 49, 49In en wordt in de natuur gepresenteerd als twee isotopen: 113In en 115In, de laatste is de meest voorkomende. Op aarde worden Indiase atomen gevonden als onzuiverheden in zink en loodmineralen.
Het is een bepaald metaal, omdat het de zachtste is die kan worden aangeraakt zonder veel gezondheidsrisico's; In tegenstelling tot lithium en rubidium, dat de huid vreselijk zou verbranden als ze reageren met zijn vocht. Een stuk Indiaas kan worden gesneden met een mes en breuk met de kracht van de vingers, die een onderscheidende crunch uitzendt.
Degene die van dit metaal hoort, zal zeker in me op India komen, maar zijn naam is afgeleid van Indigo -kleur, die wordt waargenomen wanneer de vlamtest wordt uitgevoerd. In deze zin ziet het er behoorlijk wat kalium uit, zijn metaal of zijn verbindingen verbrand met een zeer karakteristieke vlam, waardoor de Indiaan voor het eerst werd gedetecteerd in Sphenset Minerals.
De Indiase deelt veel chemische kwaliteiten met aluminium en gallium, die zich in de meeste verbindingen presenteren met een oxidatienummer van +3 (in3+)). Het combineert uitstekend met Gallië die legeringen vormt met lage smeltpunten, een daarvan is de Galinstan.
Indiase toepassingen zijn gebaseerd op de voering van materialen met hun legeringen, waardoor ze elektrische en flexibele geleiders zijn. De Indiaan heeft wat glas om ze grotere glitters te verlenen, ter vervanging van het zilver. In de wereld van technologie is de Indiaan te vinden op de aanraakschermen en LCD.
Ontdekking
In 1863 was de Duitse chemicus Ferdinand Reich op zoek naar sporen van het Talio -element, met behulp van de groene lijn van zijn emissiespectrum, in CINC -mineralen; Specifiek monsters van sphaleriet (Zns) rond Saksen. Na het roosteren van de mineralen, verwijdert u hun zwavelgehalte, verteert u ze in zoutzuur en de destillatie van het zinkchloride, verkreeg een Pajizo -neerslag.
Gezien de bevinding besloot Reich een spectroscopische analyse uit te voeren; Maar omdat hij geen goede ogen had om de kleuren te observeren, ging hij naar zijn collega Hariomus Theodor Richter om hem te helpen bij deze taak. Richter was degene die een blauwachtige spectrale lijn observeerde, die niet overeenkwam met het spectrum van enig ander element.
Het kan u van dienst zijn: jodosezuur (HiO2): eigenschappen en gebruikDe twee Duitse chemici stonden voor een nieuw element, dat de Indiase kleur werd genoemd voor de indigo kleur van de vlam toen hun verbindingen verbrandden; En op zijn beurt komt de naam van deze kleur voort uit het Latijnse woord Indicum, Wat betekent India.
Een jaar later, in 1864, opgewonden en na een langdurige reeks regenval en zuiveringen, isoleerden ze een monster van metalen Indiaan door de elektrolyse van hun opgeloste zouten in water.
Indiase structuur
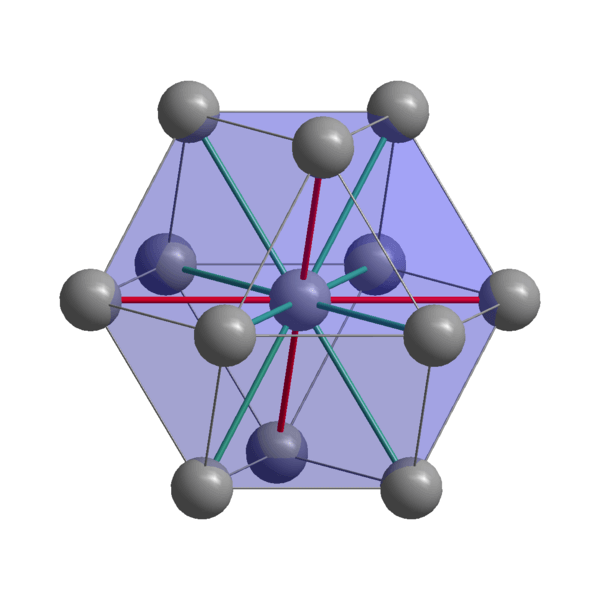 Indiase kristallijne structuur
Indiase kristallijne structuur Indiase, in, cohesie -atomen die hun valentie -elektronen gebruiken om een metaalbinding te vestigen. Zo worden ze geordend in een vervormde tetragonale structuur gecentreerd op het lichaam. De interacties tussen de in-in-in-in-in-borboratomen zijn relatief zwak, wat verklaart waarom de Indiaan een laag smeltpunt heeft (156 ºC).
Aan de andere kant zijn de krachten die twee of meer Indiase kristallen verenigen, ook niet sterk, anders zouden ze niet bovenop elkaar bewegen, waardoor de karakteristieke zachtheid van het metaal werd overgedragen.
Indiase eigenschappen
Fysiek uiterlijk
Het is een opmerkelijk zacht zilveren metaal. Het kan scheuren met de druk van de nagel, gesneden met een mes of krassen in heldere slagen op een vel papier. Het is zelfs mogelijk om het te kauwen en te vervormen met de tanden, op voorwaarde dat deze is afgevlakt. Het is ook erg ductiel en kneedbaar, met plastic eigenschappen.
Wanneer de Indiaan verwarmd met een fakkel een vlam van een indigo -kleur afwijst, nog helderder en kleurrijker dan die van kalium.
Molaire massa
114.81 g/mol
Smeltpunt
156.60 ºC
Kookpunt
2072 ºC.
Net als de Gallië heeft de Indiaan een groot temperatuurinterval tussen zijn fusiepunt en het koken. Dit weerspiegelt het feit dat de in-in-interacties in de vloeistof sterker zijn dan die welke overheersen in het glas; En daarom is het gemakkelijker om een druppel Indiaan te verkrijgen dan hun dampen.
 Indiase locatie in het periodiek systeem. Bron: Daniel Mayer of Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Indiase locatie in het periodiek systeem. Bron: Daniel Mayer of Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Dikte
Bij kamertemperatuur: 7,31 g/cm3
Precies op het smeltpunt: 7,02 g/cm3
Elektronegativiteit
1.78 op de Pauling -schaal
Ionisatie -energieën
Eerst: 558.3 kJ/mol
Ten tweede: 1820,7 kJ/mol
Derde: 2704 kJ/mol
Warmtegeleiding
81.8 w/(m · k)
Elektrische weerstand
83.7 nω · m
Mohs hardheid
1.2. Het is nauwelijks een beetje moeilijker dan talk (niet verwarrende vasthoudendheid).
Reactiviteit
De Indiër lost op in zuren om zouten te veroorzaken, maar lost niet op in alkalische oplossingen, zelfs niet met hete kaliumhydroxide. Reageert in direct contact met zwavel, zuurstof en halogenen.
Kan u van dienst zijn: verdunning: concept, hoe het wordt gedaan, voorbeelden, oefeningenDe Indiaan is relatief amfoterisch, maar gedraagt zich meer als basis dan als zuur, zijnde de enigszins eenvoudige waterige oplossingen. De in (oh)3 Het wordt opnieuw opgelost met de toevoeging van meer alkalis die indiate complexen veroorzaakt, in (OH)4-, Zoals bij aluminaten.
Elektronische configuratie
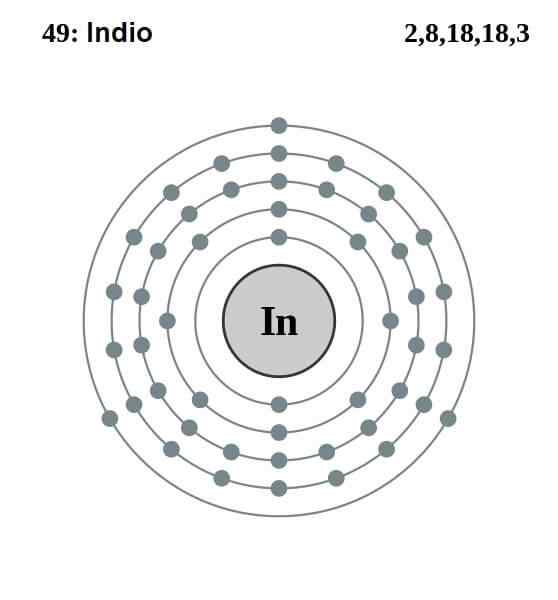 Elektronische Indiase configuratie
Elektronische Indiase configuratie De elektronische configuratie van de Indiaan is als volgt:
[KR] 4D10 5s2 5 p1
Van die dertien elektronen zijn de laatste drie van de 5s en 5p orbitalen die van Valencia. Met deze drie elektronen vestigen Indiase atomen hun metaalbinding, zoals aluminium en gallium, en vormen covalente bindingen met andere atomen.
Oxidatienummers
Het bovenstaande wordt gebruikt om meteen te staan dat de Indiaan in staat is zijn drie elektronen van Valencia te verliezen, of vijf te winnen om isolectronisch te worden tot edelgas xenon.
Als we in een compound aannemen dat het zijn drie elektronen heeft verloren, blijft het als het drievoudige kation in3+ (In analogie Al3+ en GA3+) en daarom zal uw oxidatienummer +3 zijn. De meeste Indiase verbindingen zijn in (iii).
Onder andere oxidatienummers voor de Indiaan hebben we: -5 (in5-), -2 (in2-), -1 in-), +1 (in+) en +2 (in2+)).
Enkele voorbeelden van verbindingen in (i) zijn: inf, incl, inbr, ini en in2OF. Ze zijn allemaal relatief zeldzame verbindingen, terwijl die van in (iii) de overheersende zijn: in (oh)3, In2OF3, Incl3, Inferen3, enz.
In (i) verbindingen zijn krachtige reducerende middelen, waarin de in+ Doneer twee elektronen aan andere soorten om in te worden3+.
Isotopen
De Indiaan wordt in de natuur gepresenteerd als twee isotopen: 113In en 115In, wiens land overvloed respectievelijk 4,28% en 95,72% is. Daarom hebben we op aarde veel meer atomen van 115In die van 113In. Hij 115In heeft een halfwaardetijd van 4,41 · 1014 jaren, zo geweldig dat het praktisch als stabiel wordt beschouwd, ondanks dat het een radio -isotoop is.
Momenteel zijn er in totaal 37 kunstmatige isotopen van Indiase, allemaal radioactief en zeer onstabiel gemaakt. Van al ze is de meest stabiele 111In, die een halfwaardetijd heeft van 2,8 dagen.
Gebruik/toepassingen
Legeringen
De Indiaan kan heel goed met de gallium opschieten. Beide metalen vormen legeringen die mel. Ook is de Indiaan ook gemakkelijk amalgaam, met een oplosbaarheid van 57% in Mercurius.
Kan u van dienst zijn: azijnzuur (CH3COOH)Indiase legeringen worden gebruikt om zilveren spiegels te ontwerpen zonder toevlucht te nemen tot zilver. Wanneer ze op een gebied van enig materiaal worden gegoten, fungeert het als een aanhanger, zodat glas, metaal, kwarts en keramiek kan worden verzameld.
elektronica
 Zonder de Indiaan zouden de aanraakschermen nooit hebben bestaan
Zonder de Indiaan zouden de aanraakschermen nooit hebben bestaan De Indiaan kan ook met germanio opschieten, dus zijn verbindingen worden toegevoegd als doping aan de Germanic Nituro van de LED's, en reproduceert deze mengsels blauwe lichten, paars en groen. Het maakt ook deel uit van de transistors, thermistors en fotovoltaïsche cellen.
De belangrijkste van zijn verbindingen is tin- en Indiaas oxide, dat wordt gebruikt als een glasvoering om enkele golflengten weer te geven. Hierdoor kunt u worden gebruikt in lasbril en in het krasglas zodat ze niet naar binnen verwarmen.
Glas gecoat met dit oxide zijn goede elektriciteitsgeleiders; Zoals die van onze vingers. En daarom is het bestemd voor de productie van aanraakschermen, nog meer actuele activiteit vanwege de opkomst van steeds meer smartphones.
Risico's
 Indiaan in solide staat. Bron: W. OELEN, CC BY-SA 3.0, via Wikimedia Commons
Indiaan in solide staat. Bron: W. OELEN, CC BY-SA 3.0, via Wikimedia Commons De Indiaan vertegenwoordigt in eerste instantie geen risico voor het milieu, zoals in ionen in3+ Ze zijn niet verspreid in aanzienlijke hoeveelheden. Er is geen informatie over wat de impact ervan op de bodem zou zijn, die planten beïnvloeden, en noch in fauna of zeeën.
In het lichaam is het onbekend of de ionen erin3+ Ze hebben een essentiële deelname aan het metabolisme in sporenhoeveelheden. Wanneer hun verbindingen echter worden ingenomen, zijn ze schadelijk voor verschillende organen, en daarom worden ze beschouwd als zeer giftige stoffen.
In feite, ITO -deeltjes (tin en Indiaas oxide, voor zijn acroniem in het Engels: Indiumtinoxide), onmisbaar voor de productie van schermen voor computers en smartphones, kunnen ze de gezondheid van werknemers negatief beïnvloeden, waardoor ze een ziekte worden genoemd die Indiase longen worden genoemd.
De inname van deze deeltjes komt vooral voor door inademing en door contact door de huid en ogen.
Aan de andere kant zijn fijne metalen Indiase deeltjes vatbaar voor verbranden en veroorzaken ze branden als ze hekken zijn, een warmtebron.

