Holoenzyme -kenmerken, functies en voorbeelden
- 2938
- 352
- Cecil Graham
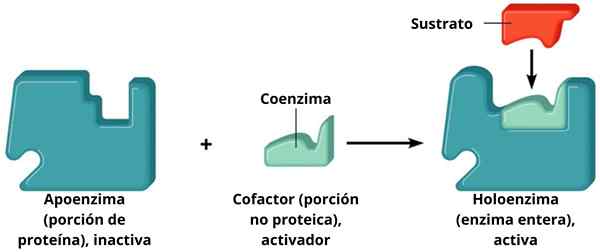
A Holoenzym Het is een enzym dat wordt gevormd door een eiwitgedeelte dat apoenzyme wordt genoemd in combinatie met een niet -eiwitmolecuul genaamd cofactor. Noch de supporter noch de cofactor zijn actief wanneer ze afzonderlijk zijn; dat wil zeggen, om te functioneren, moeten ze worden gekoppeld.
Holoenzymen zijn dus gecombineerde enzymen en zijn bijgevolg katalysator actief. Enzymen zijn een type biomoleculen waarvan de functie in feite de snelheid van celreacties verhoogt. Sommige enzymen hebben de hulp nodig van andere moleculen, cofactors genoemd.
 Ondersteuning + cofactor = holoenzyme
Ondersteuning + cofactor = holoenzyme De cofactors vullen elkaar aan met de steunen en vormen een actief holoenzym dat de katalyse uitvoert. Die enzymen die een bepaalde cofactor vereisen, staan bekend als geconjugeerde enzymen. Deze hebben twee hoofdcomponenten: de cofactor, die een metalen (anorganisch) ion of een organisch molecuul kan zijn; Het apoenzyme, eiwitgedeelte.
[TOC]
Kenmerken van holoenzymen
Gevormd door supporters en cofactors
Ondersteuning zijn het eiwitgedeelte van het complex, en cofactoren kunnen organische ionen of moleculen zijn.
Geef een verscheidenheid aan cofactors toe
Er zijn verschillende soorten cofactoren die helpen bij het vormen van holoenzymen. Sommige voorbeelden zijn co -enzymen en gewone vitamines, bijvoorbeeld: vitamine B, FAD, NAD+, vitamine C T co -enzym a.
Sommige cofactoren met metaalionen, bijvoorbeeld: koper, ijzer, zink, calcium en magnesium, onder andere. Een ander soort cofactors zijn de zo -aangedreven prothetische groepen.
Tijdelijke of permanente vereniging
Cofactoren kunnen ondersteuning verenigen met verschillende intensiteit. In sommige gevallen is de vakbond zwak en tijdelijk, terwijl de Unie in andere gevallen zo sterk is dat deze permanent is.
In gevallen waarin de vakbond tijdelijk is, wanneer de cofactor wordt geëlimineerd uit holoenzyme, wordt deze opnieuw ondersteuning en houdt hij op om actief te zijn.
Functie
Holoenzyme is een enzym dat klaar is om zijn katalytische functie uit te oefenen; dat wil zeggen, om bepaalde chemische reacties te versnellen die in verschillende gebieden worden gegenereerd.
Functies kunnen variëren afhankelijk van de specifieke werking van holoenzyme. Een van de belangrijkste staat staat het DNA -polymerase, waarvan de functie is om ervoor te zorgen dat de kopie van het DNA correct wordt gedaan.
Kan je van dienst zijn: ardipithecus: ontdekking, kenmerken, schedelVoorbeelden van gewone holoenzymen
RNA -polymerase
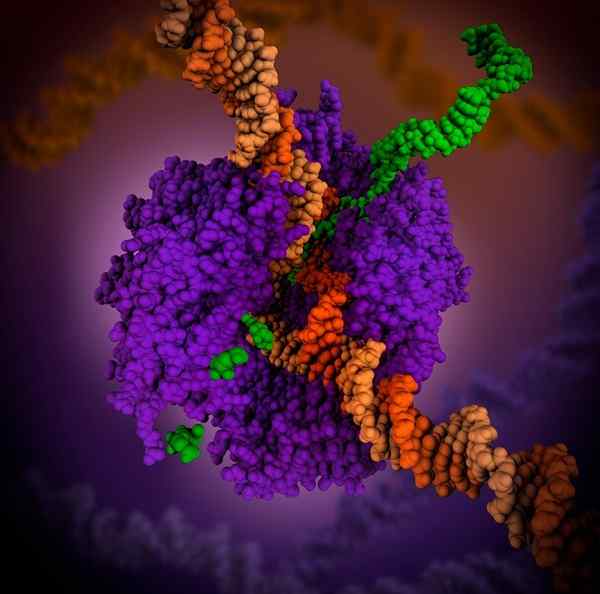 3D -polymerase RNA. Bron: Maria Voigt., CC tegen 4.0, via Wikimedia Commons
3D -polymerase RNA. Bron: Maria Voigt., CC tegen 4.0, via Wikimedia Commons RNA -polymerase is een holoenzym dat de reactie van RNA -synthese katalyseert. Dit holoenzym is nodig om RNA -ketens te bouwen van DNA -schimmelketens die als sjablonen fungeren tijdens het transcriptieproces.
De functie is om ribonucleotiden toe te voegen aan het einde 3 van een groeiend RNA -molecuul. In prokaryoten heeft RNA -polymerase -ondersteuning een cofactor genaamd Sigma 70 nodig.
DNA -polymerase
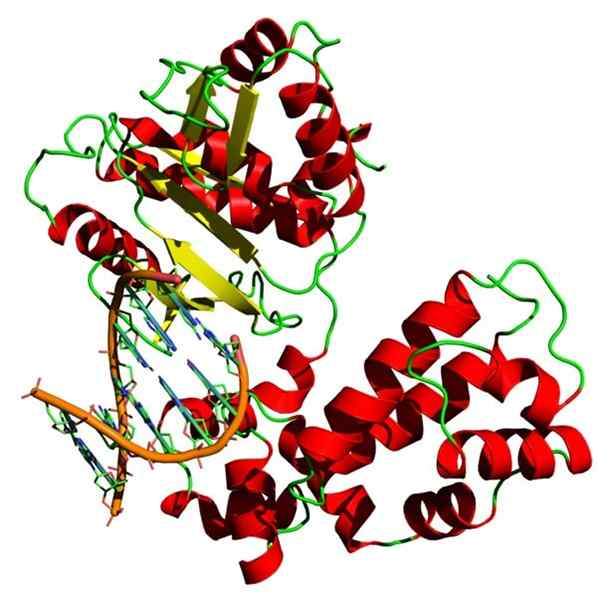 Homiens homo sapiens bèta bèta -DNA -structuur. Bron: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons
Homiens homo sapiens bèta bèta -DNA -structuur. Bron: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons DNA -polymerase is ook een holoenzyme dat de DNA -polymerisatiereactie katalyseert. Dit enzym vervult een zeer belangrijke functie voor cellen omdat het verantwoordelijk is voor het repliceren van genetische informatie.
DNA -polymerase heeft een ion nodig met positieve lading, normaal magnesium, om zijn functie uit te voeren.
Er zijn verschillende soorten DNA -polymerase: DNA -polymerase III is een holoenzym dat twee centrale enzymen (Pol III) heeft, elke verbinding van drie subeenheden (α, ɛ en θ), een glijdende klem met twee bèta -subeenheden en een complex van belasting instelling met meerdere subeenheden (Δ, τ, γ, ψ en χ).
Koolhydrase
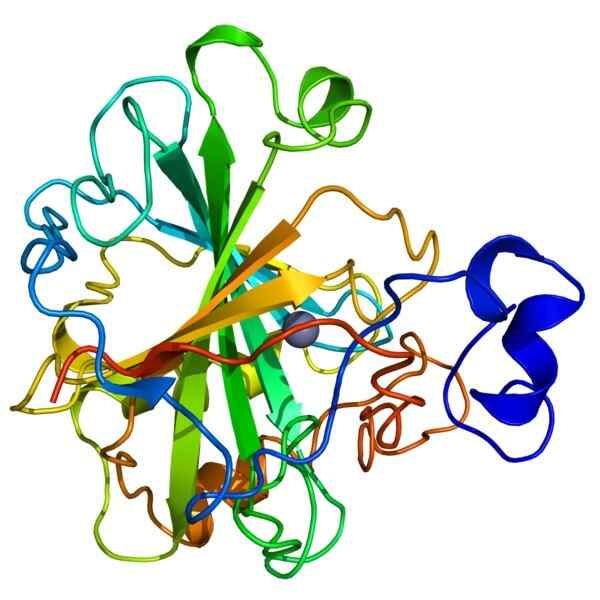 Koolstofanhydrasestructuur
Koolstofanhydrasestructuur Carbonisch anhydrase, ook wel carbonaatuitdroging genoemd, behoort tot een familie van holoenzymen die de snelle omzetting van koolstofdioxide (CO₂) en water (H20) in bicarbonaat (H2CO3) en protonen (H+) katalyseren (H+) (H+).
Het enzym vereist een zinkion (Zn+2) als een cofactor om zijn functie uit te voeren. De reactie gekatalyseerd door koolzuuranhydrase is omkeerbaar, om deze reden wordt de activiteit ervan als belangrijk geacht, omdat het helpt bij het handhaven van de zuur-base-balans tussen bloed en weefsels.
Hemoglobine
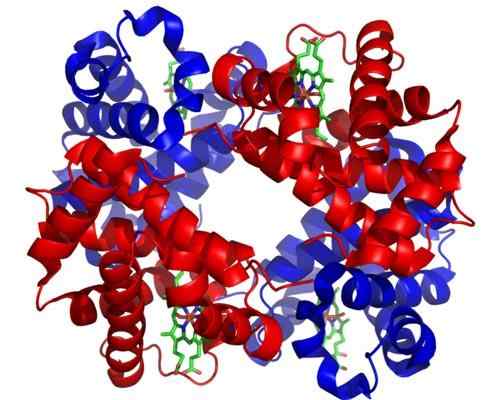 Hemoglobine
Hemoglobine Hemoglobine is een zeer belangrijk holoenzym voor het transport van gas in dierlijke weefsels. Dit eiwit aanwezig in rode bloedcellen bevat ijzer (Fe+2), en de functie ervan is om zuurstof van de longen naar andere delen van het lichaam te transporteren.
Kan u van dienst zijn: fotosynthetische organismenDe moleculaire structuur van hemoglobine is een tetrameer, wat betekent dat deze is samengesteld uit 4 polypeptideketens of subeenheden.
Elke subeenheid van dit holoenzyme bevat een hemobroep en elke hemobroep bevat een ijzeratoom dat zich kan aansluiten bij zuurstofmoleculen. De Hemoglobin Hemo Group is zijn prothetische groep, noodzakelijk voor zijn katalytische functie.
Cytochroom oxidase
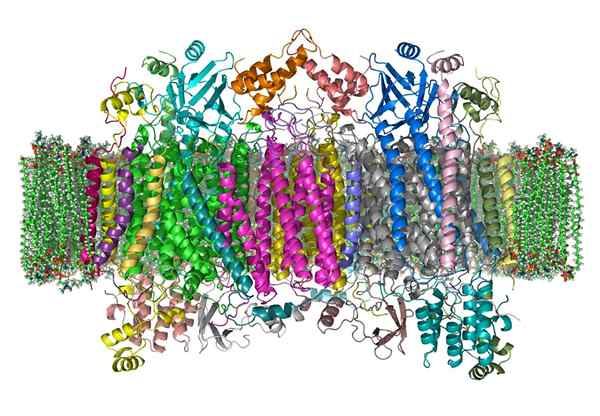 Cytochroom oxidase
Cytochroom oxidase Het oxidase -cytochroom is een enzym dat deelneemt aan de energie -verkrijgende processen, die worden uitgevoerd in de mitochondriën van bijna alle levende wezens.
Het is een complex holoenzym dat de samenwerking van bepaalde cofactoren, ijzer- en koperionen vereist om de elektronenoverdrachtsreactie en ATP -productie te katalyseren.
Pyruvaatkinase
 Cytochroom oxidase
Cytochroom oxidase Het kinasepyruvaat is een ander belangrijk holoenzym voor alle cellen, omdat het deelneemt aan een van de universele metabole routes: glycolyse.
De functie ervan is om de overdracht van een fosfaatgroep van een molecuul genaamd fosfoenolpyruvaat te katalyseren naar een ander molecuul genaamd difosfaat adenosine, om ATP en pyruvaat te vormen.
Ondersteuning vereist kaliumkationen (k ') en magnesium (mg+2) als cofactoren om functioneel holoenzyme te vormen.
Carboxylase pyruvaat
 Carboxylase pyruvaat
Carboxylase pyruvaat Een ander belangrijk voorbeeld is het carboxylase -pyruvaat, een holoenzy. Pyruvaat wordt dus oxalacetaat, een belangrijke tussenpersoon in het metabolisme.
Om functioneel actief te zijn, vereist het Foose -carboxylase -pyravaat een cofactor genaamd Biotin.
Acetyl COA carboxylase
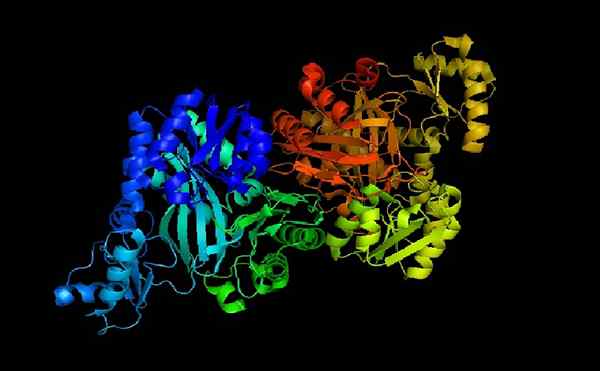 Acetyl COA carboxylase E-coli
Acetyl COA carboxylase E-coli Acetyl-CoA-carboxilase is een holoenzym waarvan de cofactor, zoals aangegeven door zijn naam, het co-enzym is.
Wanneer apoenzyme en co-enzym A zijn gekoppeld, is holoenzym katalytisch actief om zijn functie uit te voeren: breng een carboxylgroep over naar acetyl-CoA om het in malonylcoenzyme A te veranderen (malonyl-coa).
Kan u van dienst zijn: krul: samenstelling, delen, belangAcetyl-CoA vervult belangrijke functies in zowel diercellen als plantencellen.
Oxidase monoamine
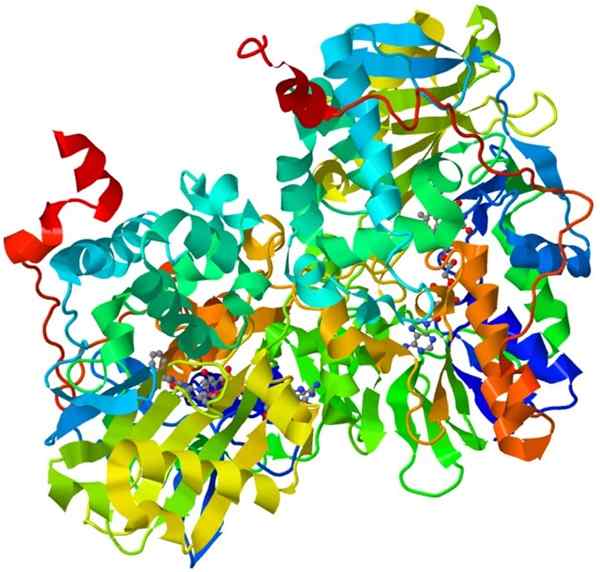 Oxidase monoamine structuur
Oxidase monoamine structuur Dit is een belangrijk holoenzym in het menselijke zenuwstelsel, de functie ervan is om de afbraak van bepaalde neurotransmitters te bevorderen.
Om oxidase -monoamine katalytisch actief te laten zijn, moet het zijn cofactor, de flavine en adeninedinucleotide (FAD), covalent verenigen.
Lactaatdehydrogenase
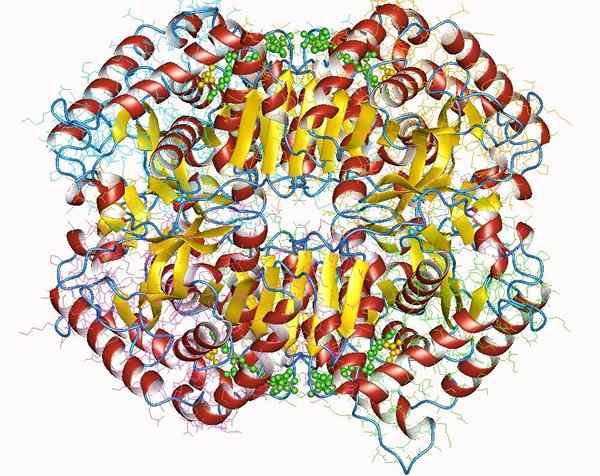 Lactaatdehydrogenase
Lactaatdehydrogenase Lactaatdehydrogenase is een belangrijk holoenzym voor alle levende wezens, met name in weefsels die veel energie verbruiken, zoals hart, hersenen, lever, skeletspier, longen, onder andere.
Dit enzym vereist de aanwezigheid van zijn cofactor, de nicotinamide en adenine (NAD), om de conversiereactie van lactaatpyruvaat te katalyseren.
Catalase
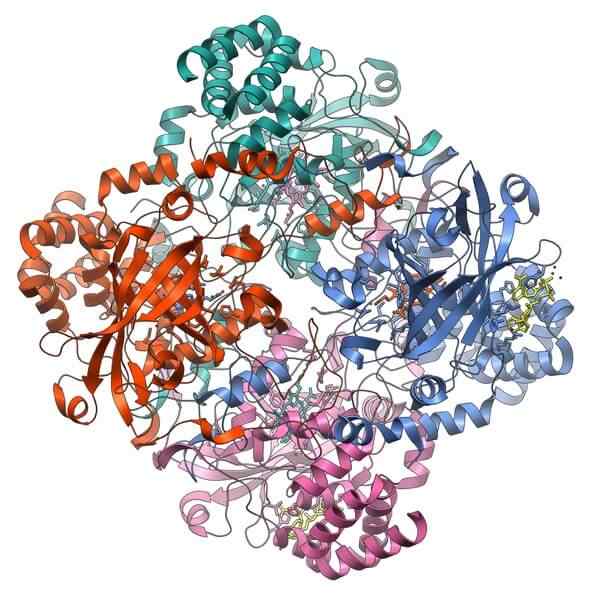 Catalase -eiwitstructuur. Bron: Vossman, CC BY-SA 3.0, via Wikimedia Commons
Catalase -eiwitstructuur. Bron: Vossman, CC BY-SA 3.0, via Wikimedia Commons Catalase is een belangrijk holoenzym bij het voorkomen van celtoxiciteit. De functie ervan is om waterstofperoxide, product van celmetabolisme, zuurstof en water te ontleden.
De ondersteuning van Catalase vereist twee cofactoren om te activeren: een mangaanion en een hemo -prothetische groep, vergelijkbaar met hemoglobine.
Referenties
- Athappilly, f. K., & Hendrickson, W. NAAR. (negentienvijfennegentig). Structuur van het biotinyldomein van acetyl-co-enzym Een carboxylase bepaald door MAD Fasing. Structuur, 3(12), 1407-1419.
- Berg, J., Tymoczko, J., Gatto, g. & Strayer, L. (2015). Biochemie (8e ed.)). W. H. Freeman en bedrijf.
- Fegler, j. (1944). Functie van koolstofanhydrase in bloed. Natuur, 137-38.
- Gaweska, h., & Fitzpatrick, p. F. (2011). Structuren en mechanisme van de monoamine -oxidase -familie. Biomoleculaire concepten, 2(5), 365-377.
- Gupta, v., & Bamezai, r. N. K. (2010). Menselijke pyruvaatkinase M2: een multifunctioneel eiwit. Wetenschapseiwit, 19(11), 2031-2044.
- Jitrapakdee, s., St Maurice, m., Rayment, ik., Cleland, W. W., Wallace, J. C., & Attwood, p. V. (2008). Structuur, mechanisme en regulatie van pyruvaatcarboxylase. Journal Biochemical, 413(3), 369-387.
- Muirhead, h. (1990). Isoenzymen van pyruvaatkinase. Biochemical Society -transacties, 18, 193-196.
- « 15 Milieuproblemen in Venezuela
- Flora en Fauna van de Ecuadoriaanse Sierra -vertegenwoordigersoorten »

