Natriumhydroxide (NaOH) structuur, eigenschappen, gebruik, synthese

- 4392
- 1173
- Ernesto McKenzie
Hij natriumhydroxide Het is een anorganische verbinding waarvan de chemische formule NaOH is en bestaat uit een zeer sterke metalen basis of alkali. Een oplossing van 5 %in water heeft een pH bijna 14.
Het is een zeer hygroscopische witte vaste stof en dat kan ook koolstofdioxide van de lucht absorberen om natriumcarbonaat te vormen. Commercieel komt in plastic flessen zoals pillen, die niet te veel tijd in de lucht kunnen worden blootgesteld, noch moeten ze worden gemanipuleerd met spatulas.
 Natriumhydroxidepillen op een klokglas. Bron: Geen machine-leesbare auteur verstrekt. Walkerma nam aan (op basis van copyrightclaims). [Publiek domein]
Natriumhydroxidepillen op een klokglas. Bron: Geen machine-leesbare auteur verstrekt. Walkerma nam aan (op basis van copyrightclaims). [Publiek domein] Natriumhydroxide kan worden gesynthetiseerd bij het reageren van calciumhydroxide met natriumcarbonaat. Momenteel wordt het fundamenteel gesynthetiseerd door pekelelektrolyse en is het een secundair product van de productie van gaschloorproductie.
Geven. Het wordt ook gebruikt bij het reinigen van thuis, waterbehandeling, aluminiumverwerking, geneeskundeproductie, enz.; En bovenal is het een secundair patroon bij uitstek.
Natriumhydroxide is zeer corrosief, in staat om irritatie en huidbrandwonden en ogen te produceren. Door het inademen van het stof kan het longoedeem veroorzaken. Ondertussen kan de inname ervan zulke ernstige verwondingen veroorzaken aan het spijsverteringskanaal dat tot de dood kan leiden.
[TOC]
Structuur
Watervrij
 NaOH -ionen. Bron: Gabriel Bolívar.
NaOH -ionen. Bron: Gabriel Bolívar. De superieure afbeelding toont de ionen die Naoh vormen. Het na -kation+ Het wordt weergegeven door de paarse bol, terwijl hydroxylanion (hydroxide of oxydril) oh- Voor de rode en witte bol. Beide na ionen+ en oh- Ze interageren met elkaar door de elektrostatische aantrekkingskracht van hun tegengestelde belastingen.
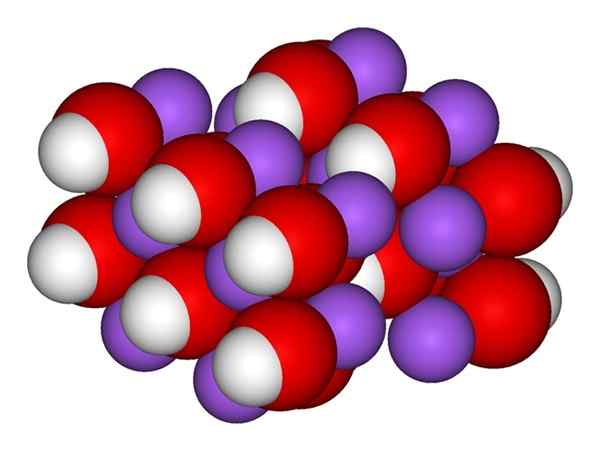 Natriumhydroxidestructuur
Natriumhydroxidestructuur Dergelijke interacties zijn niet -directioneel, dus de aantrekkingskracht van een ionische Na+Oh- kan anderen op een bepaalde afstand beïnvloeden. Het resultaat is dat na ionen+ Ze stoten elkaar af, op dezelfde manier als de OH-, Tot het definiëren van een minimaal energiekristal waar ze een geordende en periodieke structuur vaststellen (kristallijn).
Daarom verschijnen de ortorrombische kristallen van NaOH Anhydro (zonder water):
 Weergave van de kristallijne structuur van watervrij natriumhydroxide. Bron: Quibik via Wikipedia.
Weergave van de kristallijne structuur van watervrij natriumhydroxide. Bron: Quibik via Wikipedia. De ionen blijven samenhangend genoeg voor het NAOH -watervrije kristal om 323 ºC te baseren (op voorwaarde dat er geen vocht in de omgeving is).
Hydrateren
Zowel de NA+ Zoals oh- Het zijn ionen die wat watermoleculen solvetan (hydraat) gemakkelijk hebben. Dit bevordert zijn hydratatie boven de reticulaire energie van zijn kristallen, dus NaOH brengt veel energie vrij wanneer het in contact komt met water.
Het kan u van dienst zijn: fehling -reactie: voorbereidingen, actieve agenten, voorbeelden, gebruikWatervrije kristallen kunnen echter watermoleculen hosten zonder op te lossen; dat wil zeggen, natriumhydroxide kan talloze hydraten vormen, NaOH · NH2OF. Het watermolecuul kan goed een waterstofbrug vormen met OH- (HOH-OH-), of coördineren met de NA+ (NA+-Oh2)).
Afhankelijk van de molaire aandeel tussen NaOH en H2Of, monohydraten kunnen ontstaan (NaOH · h2O), dihydraten (NaOH · 2H2O), Trihemacrates (NaOH · 3.5h2O), Tetrahydraten (NaOH · 4H2O), HEPTAHRIDATES (NaOH · 7H2O), en anderen.
Elk deze hydraten kunnen kristalliseren uit een waterige NaOH -oplossing met verschillende massapercentages en bij verschillende temperaturen. Bijgevolg vertoont NaOH een gecompliceerd diagram voor oplosbaarheid in water.
In het algemeen zijn hydrates kristallen minder dicht en hebben ze lagere smeltpunten. Dit komt omdat de watermoleculen de interacties tussen NA "belemmeren"+ en oh-, Dipole-dipoolkrachten toevoegen in opoffering van ionische attracties.
Fysische en chemische eigenschappen
Namen
IUPAC Preferred Name: Natriumhydroxide. Andere namen: Caustic Soda, Ascarita (minder gebruikelijk)
Molaire massa
39.9971 g/mol
Verschijning
Vaste of witte, sereuze of ondoorzichtige kristallen.
Smeltpunt
323 ºC
Kookpunt
1.388 ºC
Oplosbaarheid in water
1.000 g/l bij een temperatuur van 25 ºC. Dit laat zien hoeveel het in water kan oplossen.
De waterige oplossingen zijn viskeus, met een viscositeitswaarde die bijna tachtig keer groter is dan die van water, en geven in het begin zeer warmte vrij. Als u contact met hen hebt, draaien ze de gladde huid, vanwege de verzeping van de vetzuren van de huid.
Basicity (PKB)
- 0,56
pH
Een 5 % P/P -oplossing in water heeft een pH bijna 14
Brekingsindex (ND)
Bij een golflengte van 580,4 nm: 1,433 tot 320 ºC en 1.421 tot 420 ° C.
Stabiliteit
De containers die het bevatten, moeten strak worden gesloten om de vorming van natriumcarbonaat te voorkomen. Dit komt door zijn hoge hygroscopiciteit, waardoor het het vocht van zijn omgeving en zijn co -inhoud absorbeert2.
Ontleding
Wanneer verwarmd tot ontleding straalt een rook uit natriumoxide uit.
Zelfsturingspunt
Het is niet ontvlambaar
Smurrie
4.0 cpoise bij 350 ºC
Verdampingswarmte
175 kJ/mol a 1.388 ºC
Oppervlaktespanning
74,35 dynas/cm in een 2,72 % p/p -oplossing in water bij 18 ° C.
Reactiviteit
Met zuren
Reageert met organische en anorganische minerale zuren, waardoor water en het overeenkomstige zout worden veroorzaakt. In het geval van zwavelzuur is de reactie exotherme.
Kan u van dienst zijn: aluminiumsulfide (AL2S3): structuur, eigenschappen, gebruik2 NaOH+H2SW4 => NA2SW4 + 2 H2OF
Met zuuroxiden
Reageert met zwaveldioxide, bijvoorbeeld, geeft een zout van sulfiet en water:
2 NaOH +So2 => NA2SW3 + H2OF
Met metalen
De waterige oplossingen reageren met sommige metalen om complexe natriumzouten te veroorzaken. Zijn reactie met zink geeft bijvoorbeeld aanleiding tot een natriumzincato:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Synthese
Natriumhydroxide wordt voornamelijk gesynthetiseerd door twee methoden: het gebruik van natriumcarbonaat, aanvankelijk gebruikt, en natriumchloride -elektrolyse, momenteel van groter industrieel gebruik.
Natriumcarbonaatreactie en calciumhydroxide
Natriumcarbonaat reageert met calciumhydroxide in een proces dat bekend staat als bijstel:
CA (oh)2 + NA2CO3 => Caco3 + Nao
Calciumcarbonaat neerslaat, waardoor natriumhydroxide achterblijft in het supernatant, dat wordt geconcentreerd door verdamping.
Natriumcarbonaat komt eerder uit het Solvay -proces:
2 NaCl+ Caco3 => NA2CO3 + Splitsen2
Natriumchloride -elektrolyse
Natriumchloride -elektrolyse, aanwezig in pekel, produceert waterstofgas, chloridegas en natriumhydroxide in waterige oplossing:
2 NaCl+2 H2O => H2 + Klet2 + 2 NaOH
De elektrolytische kamer bestaat uit een compartiment waarbij de anode (+), van titaniummetaal en plaats waar de pekel wordt geplaatst. Dit compartiment is gescheiden van het kathodecompartiment (-) met behulp van een poreus membraan.
De volgende reactie treedt op bij de anode:
2 Cl- => Cl2 + 2 e- (oxidatie)
Ondertussen vindt deze reactie plaats in de kathode:
2 H2O +2 E- => H2 + Oh- (afname)
Het natrium (NA+) diffunderen van het anodecompartiment naar de kathode, door het membraan dat ze scheidt, waardoor natriumhydroxide wordt gevormd.
Toepassingen
Schoonmaakproducten
Natriumhydroxide wordt gebruikt voor de productie van zeep en wasmiddelen die thuis en in commerciële activiteit worden gebruikt. De combinatie van natrium- en chloorhydroxide produceert chloor bleekmiddel, gebruikt in witte kleding wassen.
Het elimineert ook de accumulatie van vet in de afvoeren, waardoor de eliminatie ervan door zijn conversie in zeep door het verzepingsproces wordt geproduceerd. Dit maakt het mogelijk om de obstructie van huishoudelijke pijpen en andere gebouwen te elimineren.
Farmaceutische en medicinale producten
Natriumhydroxide wordt gebruikt bij de uitwerking van gemeenschappelijke analgetica, zoals aspirine. Ook van medicijnen met anticoagulerende werking die de vorming van bloedstolsels en medicijnen blokkeren om hypercholesterolemie te verminderen.
Energieprocessen
Natriumhydroxide wordt gebruikt bij de productie van brandstofcellen die als batterijen fungeren om elektriciteit te produceren voor een verscheidenheid aan toepassingen, waaronder transport. Epoxyharsen, vervaardigd met natriumhydroxide -interventie, wordt gebruikt in windturbines.
Het kan u van dienst zijn: Galvanische corrosie: mechanismen, voorbeelden, beschermingWater behandeling
Natriumhydroxide wordt gebruikt om de zuurgraad van de water te neutraliseren en bij te dragen aan de eliminatie van zware metalen ervan. Het wordt ook gebruikt voor de productie van natriumhypochloriet, een waterdetinfectiemiddel.
Natriumhydroxide reageert met aluminiumsulfaat voor de vorming van aluminiumhydroxide: flocculant middel gebruikt in waterbehandelingsplanten om deeltjessedimentatie te vergroten, waardoor de verduidelijking van deeltjes wordt geproduceerd.
Papierproductie
Natriumhydroxide wordt gebruikt met natriumsulfide bij de behandeling van hout om cellulose te verkrijgen, op een bijna pure manier, die de basis van het papier vormt. Het wordt ook gebruikt bij het recyclen van het papier, omdat het door de inkt te scheiden, het ons in staat stelt het opnieuw te gebruiken.
Industriële fabricage
Natriumhydroxide wordt gebruikt bij de productie van Rayón, Spandex, Explosieven, Epoxy -harsen, glas en keramiek. Het wordt in de textielindustrie gebruikt voor kleurstoffen en verwerken katoenstoffen.
In suikerrietzuiveringsinstallaties wordt lage temperatuur natriumhydroxide gebruikt voor de productie van suikerriet Bagazo.
Risico's
Natriumhydroxide is een zeer corrosieve verbinding, dus het kan, door contact met de huid, brandwonden, ampalen en zelfs permanente littekens veroorzaken.
In contact met de ogen kan het ernstige brandwonden, zwelling, pijn, wazig zien en in ernstige gevallen produceren, kan het permanente blindheid veroorzaken.
Natriumhydroxide -inname kan brandwonden veroorzaken aan de lippen, tong, keel, slokdarm en maag. Onder de gebruikelijke symptomen worden misselijkheid, braken, maagkrampen en diarree gemanifesteerd.
Hoewel natriumhydroxide -inademing zeldzaam is en alleen kan optreden vanwege de aanwezigheid van samengesteld stof in de lucht of door de vorming van een dauw die het bevat, produceert het een irritatie in de longen.
In het geval van een chronische blootstelling kan dit longoedeem en ernstige ademhalingsverkorting veroorzaken, wat een medisch noodgeval vormt.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Hydroxide natrium. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Hydroxide natrium. PubChem -database. CID = 14798. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Amerikaanse elementen. (2019). Natriumhydroxide oplossing. Opgehaald uit: Amerikaan.com
- Feiten voor chemische veiligheid. (2019). Hydroxide natrium. Teruggewonnen uit: chemicalsafetyfacts.borg
- NJ Health. (2015). Hydroxide natrium. [PDF]. Hersteld van: nj.Gov
- Canadian Center for Occupational Health & Safety. (2019). OSH beantwoordt feitenbladen: natriumhydroxide. Hersteld van: Cohs.AC
- Ausetute. (S.F.)). Natriumhydroxide en chloorproductie door elektrolyse. Hersteld van: ausetute.com.Au
- « Chol taal oorsprong, kenmerken, waar word je gesproken, woorden
- Geïndexeerde tijdschriftenkenmerken, criteria, invloedrijke voorbeelden »

