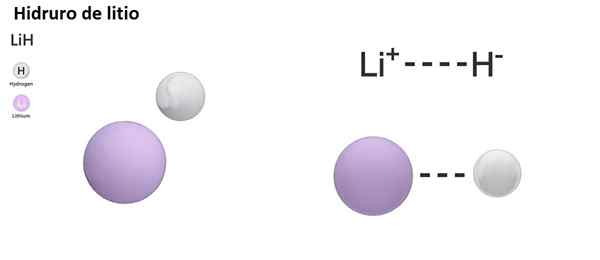Hydroren
- 2531
- 650
- Lonnie Rohan
Wat zijn Hydruros?
Hydros zijn chemische verbindingen die het gevolg zijn van de reactie van waterstof met metaalelementen (natrium, kalium, calcium, enz.) en niet metalen (chloor, fluor, zuurstof, stikstof, koolstof, enz.)). Waterstof reageert met bijna alle chemische elementen, dus hydroren zijn zeer diverse stoffen.
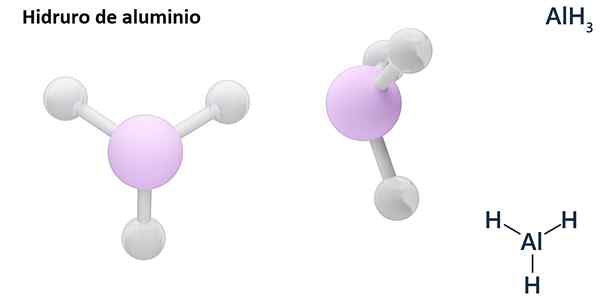
De algemene formules kunnen het MH -type zijnN, Waar m metaal is en N zijn Valencia (+1, +2, +3), zoals aluminiumhydride, ALH3; of van het eh -typeN of hNEn, waar E een niet -metalen element is en N Zijn Valencia, zoals NH3 of h2S.
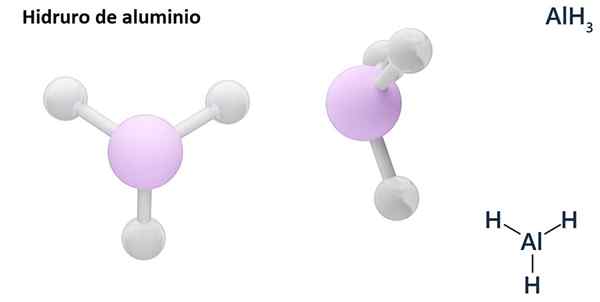
Hydros zijn meestal binaire verbindingen, dat wil zeggen ze het gevolg zijn van de combinatie van waterstof met een ander chemisch element. Waterstof kan echter ook combinaties vaststellen met verschillende chemische elementen, om complexere hydroren te vormen. Alle uitgelegde hydroren zullen binair zijn, zoals ALH3 en nee.
Er zijn drie soorten hydroren volgens de aard van zijn chemische binding: ionisch, moleculair en metaalachtig. Ionische of zoutoplossinghydroren worden gekenmerkt door de aanwezigheid van een ionische binding. Deze link bestaat uit de elektrische aantrekkingskracht tussen de positieve belasting van een alkalisch metaal (NA+) of alkalische bundel (mg2+), en de negatieve belasting van hydride -anion (h-)).
Moleculaire hydriden daarentegen worden gekenmerkt door de vorming van een covalente binding tussen waterstof en een niet -metalen element. Onder de niet -metalen elementen die hydros vormen, zijn: chloor, broom, fluor, jodium, zuurstof en stikstof.
En metaalhydroren zijn het gevolg van de combinatie van waterstof met enkele overgangsmetalen. Dit type hydriden hebben, in tegenstelling tot de vorige, complexe structuren en zal hier niet worden uitgelegd.
Hydros -eigenschappen
De eigenschappen van hydrurken variëren afhankelijk van het type hydride: ionisch, moleculair of metaalachtig, zodat hun eigenschappen afzonderlijk moeten worden aangegeven.
Ionische of zoutoplossinghydroren
Het zijn kristallijne witte vaste stoffen, maar vanwege de aanwezigheid van onzuiverheden verwerven ze een grijsachtige kleur. Deze hydriden zijn niet oplosbaar in gemeenschappelijke oplosmiddelen, zoals water, alcohol, enz. Ze hebben ook hoge kook- en fusiepunten.
Ze hebben een hoge en gesmolten toestandsdichtheid kan elektriciteit leiden.
Ionische hydurns worden beschouwd als basis of alkalisch, omdat opgelost in watervormige hydroxiden en moleculaire waterstof vrijgeven:
NAH +H2O → H2 + Nao
De reactie van het ionische hydride met water is zeer krachtig en gevaarlijk: het produceert waterstof in een gasvorm, wat een brandbaar en ontvlambaar materiaal is.
Ionische hydurns kunnen ook reageren met metaalhalogeniden, gevormd door een metaal en een niet -metaal bekend als halogeen (MX, X = F, CL, BR, I):
Kan u dienen: dimethylanyline: structuur, eigenschappen, synthese, gebruik4 lih +alcl3 → Lialh4 + 3 licl
Lih (lithiumhydride) is een binaire verbinding; Terwijl de Lialh4 (Lithium en aluminiumhydride) is een ternaire verbinding, dat wil zeggen dat het uit drie chemische elementen bestaat.
Moleculaire of covalente hydros
Ze bevinden zich in vloeibare of gasvormige toestand in tegenstelling tot ionische hydroren, die vast zijn. Ze hebben lage kook- en fusiepunten, waarmee ze worden waargenomen dat door het verhogen van het molecuulgewicht van hydride, het kookpunt toeneemt; Behalve ammoniak (NH3), Water (h2O) en fluoride -hydride (HF).
Covalente hydriden zijn slechte elektriciteitsgeleiders en veel van hun eigenschappen zijn te wijten aan de vorming van waterstofbruggen. Covalente hydriden worden beschouwd als zuren, omdat opgelost in water zuren kan veroorzaken, bijvoorbeeld zoutzuur.
Metaalhydroren
Ze bevinden zich in vaste toestand en presenteren de donkere toon van metalen. Het zijn goede elektriciteitsgeleiders en hebben glanzende oppervlakken. Metallische hydriden die stabiel zijn in de lucht worden reagentia wanneer ze opstellen, bijvoorbeeld uraniumhydride (uh3) Presenteer deze eigenschap.
Nomenclatuur
De manier om Hydrors te noemen is eenvoudig en varieert niet te veel in een van de nomenclatures. Als het metaalmetaal of element meer dan één valentie heeft, wordt het in haakjes en met Romeins aantal gespecificeerd volgens de voorraadnomenclatuur.
Bijvoorbeeld de Feh3 wordt ijzerhydride (III) en COH genoemd2 Kobalthydro (II). Dezezelfde hydriden kunnen ook worden benoemd met de systematische nomenclatuur, die gebruik maakt van de Griekse nummers (DI, TRI, Tetra, enz.)). Dus de Feh3 wordt ijzeren trihydride genoemd en coh2 kobalt dihydruro.
De klassieke nomenclatuur wordt niet veel gebruikt voor Hydros. NAH staat bijvoorbeeld meer bekend als natriumhydride en geen natriumhydride.
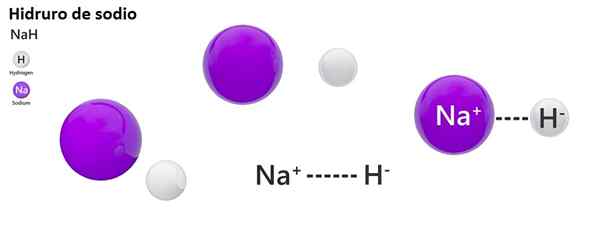 Natriumhydride
Natriumhydride Hoe worden Hydros gevormd?
Ionische of zoutoplossinghydroren
Ze worden gevormd door de reactie van waterstof met een metaal dat behoort tot de groep alkalische metalen of de groep alkalische-terrero-metalen.
In hydroren die zijn getraind met deze metalen, wordt waterstof gevonden in de H -vorm-, Bekend als hydride anion.
Alkalische metalen (lithium, natrium, kalium, rubidium en cesium) reageren met waterstof om hun overeenkomstige hydurns te vormen:
2 m (l)+h2(g) → 2mh (s)
Kan u van dienst zijn: eenheidsbewerkingenMetaal M wanneer reageren zich in een vloeibare toestand bevindt en waterstof in gasvormige toestand, dus de reactie vereist hoge temperaturen en hoge drukken. Overweeg het volgende voorbeeld:
2 li (l) +h2 (g) → 2 lih (s)
De reactie van waterstof met alkalische derde metalen (beryllium, magnesium, calcium, strontium en barium), voor hydridevorming, is vergelijkbaar met die waargenomen met alkalische metalen.
Magnesium en beryllium vormen hydriden, maar hun bindingen met waterstof zijn van het covalente type; Dat wil zeggen, niet -ionisch, in tegenstelling tot andere alkalische metalen:
Ca (l) +h2 (g) → CAH2 (S)
Moleculaire hydroren
Waterstof kan reageren met niet -metalen, overeenkomend met groepen 14, 15, 16 en 17 van het periodiek systeem, om moleculaire hydroren te vormen. Beschouw bijvoorbeeld de vorming van fluoridehydride door combinatie of direct mengsel van waterstof met fluor:
H2 (g) +f2 (g) → 2 HF (g)
HF staat meer bekend als waterstoffluoride, maar het wordt ook fluoride -hydride genoemd.
Ook kan waterstof reageren met zuurstof (groep 16 van de periodiek systeem) volgens hetzelfde schema:
2 H2 (g) +of2 (g) → 2 H2O (g)
De reactie vereist warmtetoevoer om waterstofoxide (water) of zuurstofhydride te produceren.
Ook kan waterstof reageren met stikstof, behorend tot groep 15 van het periodiek systeem om stikstofhydride te vormen, beter bekend als ammoniak (NH3)).
N2 (g) +3 H2 (g) → 2 NH3 (G)
De reactie vereist warmtevoer, hoge druk en de aanwezigheid van katalysatoren (ze versnellen chemische reacties).
Metaalhydroren
Ze worden gevormd door de reactie van overgangsmetalen (groepen 3, 4, 5, 6, 10, 11 en 12 van het periodiek systeem) met waterstof. Overgangsmetalen van groepen 7, 8 en 9 vormen echter geen verbindingen met waterstof, een fenomeen dat bekend staat als hydridegap of opening hydride.
Een uniek kenmerk van overgangsmetalen Hydrors is dat ze niet altijd een vaste aandeel presenteren tussen het aantal waterstofatomen en het aantal aanwezige atomen in hydride. Dat wil zeggen, hun formules en structuren zijn niet eenvoudig te vertegenwoordigen.
Gebruikt/toepassingen van Hydros
 Hydros zijn erg aanwezig in een van de vele soorten batterijen: zoals NIMH. Bron: Multicherry, CC BY-SA 4.0, via Wikimedia Commons
Hydros zijn erg aanwezig in een van de vele soorten batterijen: zoals NIMH. Bron: Multicherry, CC BY-SA 4.0, via Wikimedia Commons Hydros zijn aanwezig in nikkelmetallische hydridebatterijen (NIMH), gezamenlijk gebruikt met zeldzame aardmetalen, kobalt of mangaan. Verschillende metaalhydroren zijn onderzocht voor gebruik in elektrische auto's aangedreven door waterstofgerelateerde cellen.
Kan u van dienst zijn: Redox Balance -methode: stappen, voorbeelden, oefeningenReducerende middelen
Lithiumhydride en natriumboor (NABH4) Ze worden gebruikt als chemische reacties in organische synthesereacties.
Waterstofopslag en ander gerelateerd gebruik
Er zijn piloten van waterstofgebruik als brandstof in motorvoertuigen, maar vanwege de explosiviteit is het gebruik ervan beperkt als brandstof. Het gebruik van hydros is voorgesteld als een vorm van waterstofopslag om hun gevaar dus te regelen.
Bovendien zijn hydroren gebruikt voor zuivering en scheiding van waterstof- en temperatuursensoren.
Droogmiddelen
Calciumhydride wordt gebruikt om het water dat aanwezig is in organische oplosmiddelen te verwijderen.
Zuren zijn ontstaan met moleculaire hydroren
Bijvoorbeeld: zoutzuur wordt gevormd door de oplossing in een waterig medium van chloorhydride (HCl), met behulp van zoutzuur bij de eliminatie van oxiden die ijzer bedekken, de verzuring van oliebronnen, de productie van het chloride van calcium- en minerale behandeling.
Meststoffen
De ammoniak (NH3) Het is een hydride die wordt gebruikt als een vloeibare meststof en dient voor de synthese van verbindingen met ammoniumnitraat en ammoniumsulfaat, die worden gebruikt als meststoffen.
Water
Is de belangrijkste hydride. Het wordt gebruikt in veel industrieën met verschillende toepassingen en toepassingen. Water is de belangrijkste verantwoordelijk voor het bestaan van levende wezens.
Voorbeelden van hydroren
Ten slotte zullen andere voorbeelden van hydroren worden vermeld met hun respectieve formules en namen:
SNH4: Tin Hydride | Ph3: fosforhydride (fosfine) of fosfor trihydride |
KH: Lead Hydride | MGH2: magnesiumhydride of magnesiumdihydruro |
KH: Kaliumhydride | CH4: Carruro Carruro of koolstoftetrahydride (methaan) |
Cah2: calciumhydride | FEH2: Iron Hydride (II) |
NAH: Natriumhydride | ZnH2: zinkhydride |
LIH: Lithium Hydride | BAH2: Barium Hydride |
CSH: Cesiumhydride | BH3: BORON HYDRO (BAS |
Beh2: Beryl of Beryl dihydride hydride | SIH4: Silicon Hydro (Silan) |
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wojes, Ryan. (27 augustus 2020). Wat is een metaalhydride? Hersteld van: Thoughtco.com
- Amerikaanse elementen. (2020). Hydrididen. Opgehaald uit: Amerikaan.com
- Wikipedia. (2020). Hydride. Opgehaald uit: in.Wikipedia.borg
- Tandis Arani. (15 augustus 2020). Hydrididen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Hydride. Hersteld van: Britannica.com