Hydroxiapatiet

- 818
- 14
- Nathan Wiegand
We leggen uit wat hydroxylapatiet is, zijn structuur, hoe het wordt gesynthetiseerd, het gebruik ervan en fysische en chemische eigenschappen
 Hydroxiapatiet. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0, CC BY-SA 3.0, via Wikimedia Commons
Hydroxiapatiet. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0, CC BY-SA 3.0, via Wikimedia Commons Wat is hydroxyapatiet?
De Hydroxiapatiet Het is een calciumfosfaatmineraal, waarvan de chemische formule CA is10(PO4))6(OH)2. Samen met andere mineralen en organische en verdichte organische stof vormt het de grondstof die bekend staat als fosforrots. De term hydroxi verwijst naar anion oh-.
Als in plaats van dat anion fluoride zou zijn, zou het mineraal fluoroapatita worden genoemd (CA10(PO4))6(F)2; En dus met andere anionen (CL-, BR-, CO32-, enz.)). Evenzo is hydroxyapatiet de belangrijkste anorganische component van botten en tandglazuur, voornamelijk aanwezig in een kristallijn.
Het is dus een essentieel element in de botweefsels van levende wezens. Zijn grote stabiliteit tegen andere calciumfosfaten stelt hem in staat om fysiologische omstandigheden te ondersteunen, waardoor de botten hun karakteristieke hardheid krijgen. Hydroxiapatiet is niet alleen: het vervult zijn functie vergezeld van collageen, vezelachtig eiwit van conjunctieve weefsels.
Hydroxyapatiet (of hydroxylapatiet) bevat ca -ionen2+, Maar andere kationen kunnen ook in zijn structuur huisvesten (mg2+, NA+), onzuiverheden die betrokken zijn bij andere biochemische processen van de botten (zoals hun remodellering).
Hydroxyapatietstructuur
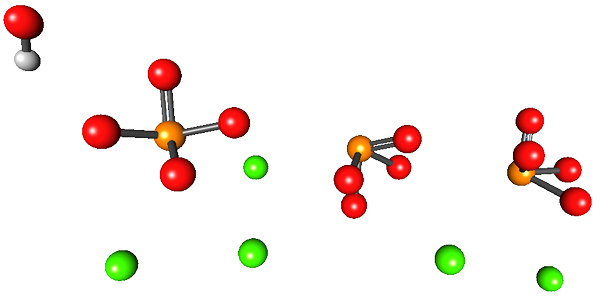
Het superieure beeld illustreert de structuur van calciumhydroxyapatiet. Alle bollen bezetten het volume van de helft van een zeshoekige "lade", waar de andere helft identiek is aan de eerste.
In deze structuur komen de groene bollen overeen met cations2+, Terwijl de rode bollen van zuurstofatomen, oranje tot fosforatomen en het wit naar de OH -waterstofatoom-.
Fosfatenionen in dit beeld hebben het defect van het niet weergeven van een tetraëdrische geometrie; In plaats daarvan lijken ze op vierkante basispiramides.
Kan u van dienst zijn: glasachtige staatOH- wekt de indruk dat het zich ver van de CA bevindt2+. De kristallijne eenheid kan zich echter herhalen op het dak van de eerste, waardoor de nauwe nabijheid tussen beide ionen wordt getoond. Ook kunnen deze ionen worden vervangen door anderen (NA+ en f-, Bijvoorbeeld).
Hydroxylapatietsynthese
Hydroxylapatiet kan worden gesynthetiseerd door reactie van calciumhydroxide met fosforzuur:
10 ca (oh)2 + 6 H3Po4 => CA10(PO4))6(OH)2 + 18 H2OF
Hydroxiapatita (CA10(PO4))6(OH)2) wordt uitgedrukt door twee Formula Ca -eenheden5(PO4))3Oh.
Evenzo kan hydroxyapatiet worden gesynthetiseerd door de volgende reactie:
10 ca (nee3))2.4h2O + 6 NH4H2Po4 => CA10(PO4))6(OH)2 + 20 NH4NEE3 + 52 H2OF
Controle van de neerslagsnelheid maakt deze reactie mogelijk hydroxyapatiet nanodeeltjes te genereren.
Hydroxyapatietkristallen

De ionen zijn verdicht en groeien tot een rigide en resistent bio -critisch. Dit wordt gebruikt als een biomateriaal van botmineralisatie.
Het heeft echter collageen nodig, organische ondersteuning die dient als een vorm van groei. Deze kristallen en hun gecompliceerde vormingsprocessen zijn afhankelijk van bot (of tand).
Deze kristallen worden geïmpregneerd met organisch materiaal, en de toepassing van elektronische microscopietechnieken beschrijft ze in de tanden als aggregaten met staafvormen die prisma's worden genoemd.
Hydroxylapatietgebruik
Medisch en tandheelkundig gebruik
Vanwege zijn gelijkenis in grootte, kristallografie en samenstelling met het harde menselijke weefsel, is nanohydroxyapatiet aantrekkelijk om te gebruiken in prothesen. Ook is nanohydroxyapatiet biocompatibel, bioactief en natuurlijk, naast niet giftig of inflammatoire.
Bijgevolg heeft nanohydroxyapatiet -keramiek een verscheidenheid aan toepassingen, waaronder:
- In Bone Tejido -chirurgie wordt het gebruikt bij het vullen van holtes in orthopedische, traumatologische, maxillofaciale en tandheelkundige operaties.
- Het wordt gebruikt als een orthopedische en tandheelkundige implantatencoating. Het is een desensibiliserend middel dat wordt gebruikt om tandheelkundig bleken te maken. Hij wordt ook gebruikt als een remineraliserend middel in tandheelkundige pasta's en vroege cariësbehandeling.
- Roestvrij staal- en titaniumimplantaten worden vaak bedekt met hydroxyapatiet om hun afstotingssnelheid te verminderen.
- Het is een alternatief voor alogene en xenogene transplantaten van botten. De genezingstijd is korter in aanwezigheid van hydroxyapatiet dan in zijn afwezigheid.
- Nanohidroxyapatiet synthetische mimetiza tot hydroxyapatiet die van nature op natuurlijke wijze aanwezig is in dentine en apatiet -enmaltisch, dus het gebruik ervan bij de reparatie van email en opname in tandpasta's is voordelig, evenals in mondvlagingen.
Ander gebruik van hydroxyapatiet
- Hydroxyapatiet wordt gebruikt in de luchtfilters van motorvoertuigen om hun efficiëntie in de absorptie en ontleding van koolmonoxide (CO) te verhogen. Dit vermindert milieuvervuiling.
- Een alginaat-hydroxyapatietcomplex is gesynthetiseerd dat veldtests hebben aangegeven dat het in staat is om fluoride via het ionenuitwisselingsmechanisme te absorberen.
- Hydroxiapathiet wordt gebruikt als een chromatografisch medium voor eiwitten. Dit heeft positieve ladingen (CA++) en negatief (PO4-3), dus het kan interageren met elektrisch geladen eiwitten en zijn scheiding mogelijk maken door ionenuitwisseling.
- Hydroxyapatiet is ook gebruikt als ondersteuning voor elektrofotische nucleïnezuren. Het is mogelijk om het DNA van het RNA te scheiden, evenals het DNA van een eenvoudige streng van de twee strengen DNA.
Fysische en chemische eigenschappen
Hydroxyapatiet is een witte vaste stof die grijze, gele en groenachtige tonen kan verwerven. Zoals een kristallijne vaste stof, presenteert het hoge fusiepunten, indicatief voor de sterke elektrostatische interacties; Voor hydroxyapatiet is dit 1100 ºC.
Het is dichter dan water, met een dichtheid van 3,05 - 3,15 g/cm3. Bovendien is het praktisch onoplosbaar in water (0,3 mg/ml), wat te wijten is aan fosfatenionen.
In zure media (zoals in HCl) is het echter oplosbaar. Deze oplosbaarheid is te wijten aan de vorming van CACL2, Zeer oplosbaar waterzout. Evenzo zijn fosfaten proton (HPO42- en h2Po4-) en interactie in een betere mate met water.
De oplosbaarheid van zure hydroxyapatiet is belangrijk in de pathofysiologie van cariës. Bacteriën in de mondholte scheiden melkzuur uit, product van glucosefermentatie, die de pH van het tandoppervlak vermindert tot minder dan 5, dus het hydroxyapatiet begint op te lossen.
Kan u van dienst zijn: sublimatie: concept, proces en voorbeeldenDe fluoride (f-) U kunt OH -ionen vervangen- In de kristallijne structuur. Wanneer dit gebeurt, biedt het weerstand tegen de hydroxyapatiet van het tandheelkundige email voor zuren.
Mogelijk kan deze weerstand te wijten zijn aan de onoplosbaarheid van CAF2 gevormd, weigeren het glas te "verlaten".
Referenties
- Shiver & Atkins. (2008). ANORGANISCHE SCHEIKUNDE. (Vierde ed., P. 349, 627). MC Graw Hill.
- Vloeistof. (2017). Hydroxylapatiet. Opgehaald uit Fluidinova.com
- Gaiabulbanix. (5 november 2015). Hydroxyapatiet. [Figuur]. Hersteld van commons.Wikimedia.borg
- Martin.NEITSOV. (25 november 2015). Hüdroksüapatiidi Kristallid. [Figuur]. Hersteld van commons.Wikimedia.borg
- Wikipedia. (2018). Hydroxylapatiet. Opgehaald van.Wikipedia.borg
- Fiona Petchey. Bot. C14Dating hersteld.com

