Hydrolasase -structuur, functies, voorbeelden

- 2105
- 460
- Lonnie Rohan
De Hydrolase Het zijn enzymen die verantwoordelijk zijn voor het hydrolyseren van verschillende soorten chemische links in veel verschillende verbindingen. Onder de belangrijkste links dat hydrolys de ester, glucosidische en peptidekoppelingen behoren.
Binnen de groep hydrolasen zijn meer dan 200 verschillende enzymen geclassificeerd, ten minste 13 individuele sets gegroepeerd; De classificatie ervan is in wezen gebaseerd op het type chemische verbinding dat als een substraat dient.
 Grafische modellering met bioinformatica -tools van de structuur van een hydrolase (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) via Wikimedia Commons)
Grafische modellering met bioinformatica -tools van de structuur van een hydrolase (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) via Wikimedia Commons) Hydrolasen zijn onmisbaar voor de spijsvertering van voedsel in de darm van dieren, omdat ze verantwoordelijk zijn voor het afbreken van een groot deel van de banden die de koolzuurhoudende structuren vormen van het voedsel dat ze innemen.
Deze enzymen werken in waterige media, omdat ze watermoleculen om hen heen nodig hebben om toe te voegen aan de verbindingen zodra de moleculen zijn gesplitst. In eenvoudige woorden, hydrolasen voeren een hydrolytische katalyse uit van de verbindingen waarop ze werken.
Wanneer een hydrolase bijvoorbeeld een C-C-covalente binding breekt, is het resultaat meestal een C-O-groep en een C-H-groep.
[TOC]
Structuur
Zoals veel enzymen zijn hydrolasen georganiseerde bolvormige eiwitten in complexe structuren die zijn georganiseerd door intramoleculaire interacties.
Hydrolasen, zoals alle enzymen, binden zich aan een of meer substraatmoleculen in een gebied van zijn structuur die bekend staat als "actieve plaats". Deze site is een zak of gespleten omringd door veel aminozuurresiduen die de grip of unie van het substraat vergemakkelijken.
Elk type hydrolase is specifiek voor een bepaald substraat, dat wordt bepaald door de tertiaire structuur en door de vorming van aminozuren die hun actieve plaats maken. Deze specificiteit werd didactisch opgevoed door Emil Fischer als een soort "sleutel en vergrendeling".
Kan u bedienen: Polymerase: kenmerken, structuur en functiesMomenteel is het bekend dat het substraat in het algemeen veranderingen of vervormingen induceert in de vorming van enzymen en dat enzymen op hun beurt de structuur van het substraat vervormen om ervoor te zorgen dat dit "kant" op zijn actieve plaats.
Functie
Alle hydrolasen hebben de belangrijkste functie van het breken van chemische bindingen tussen twee verbindingen of binnen de structuur van dezelfde molecuul.
Er zijn hydrolasen om bijna elk type link te verbreken: sommige degraderen de esterbindingen tussen koolhydraten, andere peptidebindingen tussen eiwitaminozuren, andere carbonylische bindingen, enz.
Het doel van het chemische bindingsproces gekatalyseerd door een hydrolase -enzym varieert aanzienlijk. Smozyme is bijvoorbeeld verantwoordelijk voor de hydrolyse van chemische bindingen met beschermdoeleinden van organisme die het synthetiseren.
Dit enzym degradeert de banden die bij elkaar blijven met de verbindingen in de celwand van de bacteriën, met als doel het menselijk lichaam te beschermen tegen bacteriële proliferatie en een mogelijke infectie.
Nucleas zijn "fosfatase" -enzymen die het vermogen hebben om nucleïnezuren af te breken, die ook een celafweermechanisme tegen DNA- of RNA -virussen kunnen vertegenwoordigen.
Andere hydrolasen, zoals die van het type "proteasen", degraderen de peptidebindingen van eiwitten in het spijsverteringskanaal om aminozuren te maken die in het gastro -intestinale epitheel kan worden geassimileerd.
Zelfs hydrolasen zijn betrokken bij verschillende energieproductie -gebeurtenissen in celmetabolisme, omdat fosfatasen de afgifte van fosfaatmoleculen uit hoog -energietubstraten zoals pyruvaat in glycolyse katalyseren in glycolyse, in glycolyse.
Het kan je van dienst zijn: soja -gripVoorbeelden van hydrolasasen
Onder de grote diversiteit van hydrolasen die wetenschappers hebben geïdentificeerd, zijn sommigen met meer nadruk onderzocht dan andere, omdat ze betrokken zijn bij veel essentiële processen voor het celleven.
Onder deze zijn de gladheid, de proteaseserine, de endonucleous en glucosidase of glycosyraeeuze fosfatasen.
De gladheid
Enzymen van dit type pauze. Dit veroorzaakt meestal een totale lysis van de bacteriën.
Smozymen verdedigen het lichaam van dieren van bacteriële infecties en zijn overvloedig aanwezig in lichaamsafscheidingen in weefsels die in contact zijn met de omgeving, zoals bijvoorbeeld tranen, speeksel en slijmvlies.
Het gladde kippenei was de eerste eiwitstructuur die kristalliseerde door x -reeks. Deze kristallisatie werd gemaakt door David Phillips, in 1965, bij het London Real Institute.
De actieve plaats van dit enzym bestaat uit de asparagine-alanine-mechanine-mechanine-sparagine-glycine-glycine-peragine-Plain-methionine-peptide (NAM-NAM-NAM).
Protease serin
De enzymen van deze groep zijn verantwoordelijk voor het hydrolyseren van peptidebindingen in peptiden en eiwitten. De meest bestudeerde zijn TRPSIN en Chimotripsin; Er zijn echter veel verschillende soorten proteasen, die variëren met betrekking tot de specificiteit van het substraat en het katalysemechanisme.
De "proteasen" worden gekenmerkt door een serine -type nucleofiel aminozuur te bezitten. Proteasas Serin kan ook een breed scala aan esterlinks breken.
Kan u van dienst zijn: wat is de chemische samenstelling van levende wezens?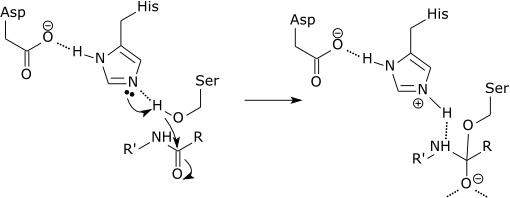 Grafisch schema van de werking van een protease die een peptidekop in het histidine-aminozuur verbreekt (bron: Zephyris bij de Engelse taal Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons)
Grafisch schema van de werking van een protease die een peptidekop in het histidine-aminozuur verbreekt (bron: Zephyris bij de Engelse taal Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/)] via Wikimedia Commons) Deze enzymen snijden peptiden en eiwitten op een niet -specifieke manier. Alle te snijden peptiden en eiwitten moeten echter worden gebonden aan het N-terminale uiteinde van de peptidekop naar de actieve plaats van het enzym.
Elk kort protease is nauwkeurig de Amida-binding die vormt tussen het C-terminale uiteinde van het aminozuur in het carboxyluiteinde en het amineozuuramine dat is naar het N-terminale uiteinde van het peptide.
Nuclease fosfatasen
Deze enzymencatalogus. Er zijn veel verschillende soorten van deze enzymen, omdat ze specifiek zijn voor het type nucleïnezuur en de snijlocatie.
 Grafisch schema van de werking van een endonuclease die een fosfodiéster-binding hydrolyseert (Bron: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Grafisch schema van de werking van een endonuclease die een fosfodiéster-binding hydrolyseert (Bron: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Endonucleasen zijn onmisbaar op het gebied van biotechnologie, omdat ze wetenschappers in staat stellen de genomen van organismen te wijzigen door fragmenten van de genetische informatie van bijna elke cel te snijden en te vervangen.
De endonucleasen maken het snijden van de stikstofbases in drie stappen. De eerste is via een nucleofiel aminozuur, waarna een intermediaire structuur wordt gevormd met negatieve belasting die de fosfaatgroep aantrekt en uiteindelijk het verband tussen de twee basen verbreekt.
Referenties
- Davies, g., & Henrissat, b. (negentienvijfennegentig). Structuren en mechanismen van glycosylhydrolas. Structuur, 3 (9), 853-859.
- Lehninger, een. L., Nelson, D. L., Cox, m. M., & Cox, m. M. (2005). Lehninger -principes van biochemie. Macmillan.
- Mathews, een. P. (1936). Principes van biochemie. W. Hout.
- Murray, r. K., Granner, D. K., Mayes, p., & Rodwell, V. (2009). Harper's geïllustreerde biochemie. 28 (p. 588). New York: McGraw-Hill.
- Ollis, D. L., Cheeah, e., CYGLER, M., Dijkstra, b., Folow, f., Franken, s. M.,… & Sussman, J. L. (1992). De α/β -hydrolase -vouw. Engineering eiwit, ontwerp en selectie, 5 (3), 197-211.

