Katalytische hydrogenering
- 2764
- 563
- Cecil Graham
 Katalytische hydrogenering is een chemische reactie waarbij het eindresultaat de toevoeging is van waterstof aan een andere verbinding. Bron: Gabriel Bolívar
Katalytische hydrogenering is een chemische reactie waarbij het eindresultaat de toevoeging is van waterstof aan een andere verbinding. Bron: Gabriel Bolívar Wat is katalytische hydrogenering?
De katalytische hydrogenering Het is de chemische reactie waardoor moleculaire waterstof wordt toegevoegd in een verbinding met hogere snelheden.
De H Molecula2 Niet alleen moet eerst zijn covalente binding breken, maar ook, zijn zo kleine, efficiënte botsingen tussen het en de verbinding naar waar het zal worden toegevoegd, zijn minder waarschijnlijk.
De waterstofreceptorverbinding is mogelijk organisch of anorganisch. In organische verbindingen zijn ze waar er de meeste voorbeelden zijn van katalytische hydrogenering, vooral die met farmacologische activiteit, of metalen hebben opgenomen in hun structuren (organometallische verbindingen).
Wanneer H wordt toegevoegd2 Naar een structuur vol koolstof, wat er gebeurt, is dat de onverzadiging ervan afneemt, dat wil zeggen dat de koolstof de maximale mate van eenvoudige links bereikt die het kan vormen.
Daarom h2 Dubbele (c = c) en drievoudige (c≡C) koppelingen worden toegevoegd, hoewel het ook kan worden toegevoegd aan koolstofilgroepen (c = o).
Aldus reageren alkenen en alkines door katalytische hydrogenering. Oppervlakkig analyseren van elke structuur, kan worden voorspeld of deze al dan niet zal toevoegen2 Detecteer gewoon dubbele en drievoudige links.
Kenmerken van katalytische hydrogenering
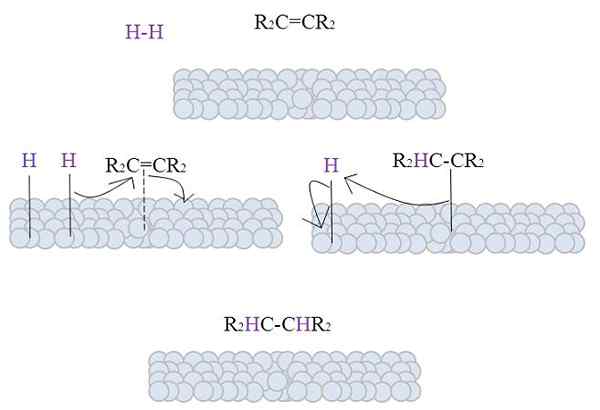
Het beeld toont het mechanisme van deze reactie. Het is echter noodzakelijk om enkele theoretische aspecten aan te pakken voordat u het beschrijft.
De oppervlakken van de grijze bollen vertegenwoordigen de metaalatomen die, zoals te zien, de katalysatoren zijn van de hydrogenering bij uitstek.
Waterstofbinding scheurt
- Hydrogenering is een exotherme reactie, dat wil zeggen dat het warmte vrijgeeft als gevolg van de vorming van lagere energieverbindingen.
Kan u van dienst zijn: acetanylide (c8h9no)- De gevormde C-H-bindingen zijn stabiel, die grotere energie vereisen voor latere breuk dan de H-H-binding van moleculaire waterstofbehoeften.
- Hydrogenering omvat altijd eerst de breuk van de H-H-link. Deze breuk kan homolitisch zijn, zoals in veel gevallen:
H-H => H ∙ + ∙ H H
Of heterolytisch, dat kan worden gegeven, bijvoorbeeld wanneer zinkoxide waterstof is, ZnO:
H-h => h+ + H-
- Het verschil tussen de twee scheuren ligt in hoe linkelektronen worden verdeeld. Als ze gelijk worden verdeeld (covalent), behoudt elke H uiteindelijk een elektron, terwijl als de verdeling ionisch is, men eindigt zonder elektronen, h+, En de andere wint ze volledig, h-.
- Beide breuken zijn mogelijk in katalytische hydrogenering, hoewel homolithicum het mogelijk maakt om hiervoor plaats te maken voor de ontwikkeling van een logisch mechanisme.
Experimenteel
- Waterstof is een gas, en daarom moet het bubbels zijn en garanderen dat alleen hij overheerst op het oppervlak van de vloeistof.
- Waterstofverbinding moet in een medium worden opgelost, of het nu water, alcohol, ether, esters of een vloeibare amine is. Anders zou de hydrogenering heel langzaam passeren.
De verbinding opgelost op waterstofarme, er moet ook een katalysator in het reactiemedium zijn. Dit is verantwoordelijk voor het versnellen van de snelheid van de reactie.
- Bij katalytische hydrogenering worden meestal fijn verdeelde metalen van nikkel, paladium, platina of rhodium gebruikt, die in bijna alle organische oplosmiddelen onoplosbaar zijn. Daarom zullen er twee fasen zijn: een vloeistof met de opgeloste verbinding en waterstof, en een vaste stof, die van de katalysator.
Het kan u van dienst zijn: Cruise for Crucible: Kenmerken, functies, gebruik voorbeelden- Deze metalen bieden hun oppervlak zodat waterstof en verbinding reageren, zodat bindingen worden versneld.
- Ze verminderen ook de verspreiding van de soort, waardoor het aantal effectieve moleculaire botsingen wordt verhoogd. Niet alleen dat, maar zelfs de reactie vindt plaats in de poriën van het metaal.
Soorten katalytische hydrogenering
Homogeen
Er is sprake van homogene katalytische hydrogenering wanneer het medium van de reactie uit een enkele fase bestaat. Hier het gebruik van metalen in hun pure toestanden, omdat ze onoplosbaar zijn.
In plaats daarvan worden organomethalische verbindingen van deze metalen gebruikt, die oplosbaar zijn, en hebben bewezen hoge opbrengsten te hebben.
Een van deze organometaalverbindingen is de Wilkinson -katalysator: Trischloride (trifenylfine) Rodio, [(C6H5))3P]3Rhcl.
Deze verbindingen vormen een complex met h2, het activeren voor zijn daaropvolgende toevoeging aan de alkeen of alquino.
Homogene hydrogenering presenteert veel meer alternatieven dan heterogeen, omdat chemie in organometaalverbindingen overvloedig is: het is voldoende om het metaal (PT, PD, RH, Ni) en de liganden (de organische of anorganische moleculen te veranderen, aan het metaalcentrum), naar aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), naar het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan het metaalcentrum), aan aan het metaalcentrum), aan Krijg een nieuwe katalysator.
Heterogeen
Heterogene katalytische hydrogenering heeft, zoals zojuist vermeld, twee fasen: één vloeistof en één vaste stof.
Naast metalen katalysatoren zijn er andere die uit een vast mengsel bestaan. Bijvoorbeeld, de Lindlar -katalysator, die bestaat uit platina, calciumcarbonaat, loodacetaat en chinoline.
De Lindlar -katalysator heeft de eigenaardigheid dat het slecht is voor de hydrogenering van alkenen. Het is echter zeer nuttig voor gedeeltelijke hydrogeneringen, dat wil zeggen dat het uitstekend werkt op de alkines:
Kan u van dienst zijn: lutecio: structuur, eigenschappen, gebruik, verkrijgenRC≡CR + H2 => Rhc = chr
Mechanisme
Het beeld toont het mechanisme van katalytische hydrogenering met behulp van een poedermetaal als katalysator.
De grijze bollen komen overeen met het metaaloppervlak van, om te zeggen, platina. Het molecuul h2 (paarse kleur) ligt dicht bij het metalen oppervlak, evenals de vervangende tetra alkeen, r2C = Cr2.
De H2 Interactie met de elektronen die de metaalatomen reizen, en een pauze en vorming van een H-M temporale link treedt op, waarbij M metaal is. Dit proces staat bekend als chemisorptie. Dat wil zeggen een adsorptie door chemische krachten.
De alkene werkt op een vergelijkbare manier op, maar de link vormt het met zijn dubbele binding (stippellijn).
De H-H-binding is al gedissocieerd en elk waterstofatoom blijft gekoppeld aan metaal. Evenzo doet het met metaalcentra in organometallische katalysatoren, waardoor een H-M-H intermediair complex wordt gevormd.
Het komt vervolgens voor een migratie van een H naar de dubbele binding, en dit opent een link met het metaal. Vervolgens sluit de resterende H zich aan bij de andere koolstof van de oorspronkelijke dubbele binding, en de geproduceerde alkaan wordt eindelijk vrijgegeven, r2HC-CHR2.
Dit mechanisme zal zo vaak als nodig worden herhaald, tot alle h2 volledig reageren.
Referenties
- Carey, f. (2008). Organische chemie. MC Graw Hill.
- Shiver & Atkins (2008). Anorganische scheikunde. MC Graw Hill.
- Lew, J. (S.F.)). Katalytische hydrogenering van alkenen. Chem hersteld.Librhetxts.borg
- Wat is katalytische hydrogenering? - Mechanisme en reactie. Studie hersteld.com

