Onverzadigde koolwaterstoffen
- 663
- 138
- Glen Armstrong
We leggen uit welke onverzadigde koolwaterstoffen, hun classificatie, eigenschappen, nomenclatuur en verschillende voorbeelden geven
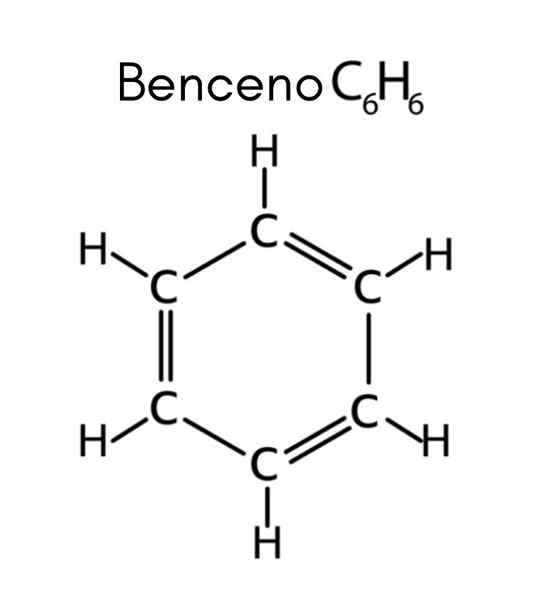
 Benzeen is een voorbeeld van onverzadigde koolwaterstof
Benzeen is een voorbeeld van onverzadigde koolwaterstof Wat zijn onverzadigde koolwaterstoffen?
De onverzadigde koolwaterstoffen Het zijn organische verbindingen die alleen worden gevormd door koolstof en waterstof, die een of meer meerdere bindingen hebben tussen koolstofatomen. Dit betekent dat elke formule C -verbindingXHEn die een dubbele of een drievoudige binding presenteren, is een onverzadigde koolwaterstof.
Onverzadigde koolwaterstoffen worden gevormd door alkenen en alkines, evenals aromatische verbindingen. De reden waarom ze onverzadigd zijn, is omdat ze een kleiner aantal hydrogenen hebben dan het maximum dat ze konden hebben, gezien het aantal koolstofatomen in de structuur.
Onverzadigde koolwaterstoffen worden herkend door minder dan 2n+2 hydrogenen te hebben (wat het maximale aantal hydrogenen is dat koolstof kan zijn), waarbij n het aantal koolstofatomen in de moleculaire formule is.
Een voorbeeld van onverzadigde koolwaterstof is de buteno, waarvan de moleculaire formule c is4H8. Het maximale aantal hydrogenen voor 4 koolstofatomen zou zijn 2 (4) +2 = 10 hydrogenen. Dit komt overeen met het aantal hydrogenen van een verzadigde koolwaterstof. Aangezien de buteno slechts 8 hydrogenen heeft, wat minder dan 10 is, is het een onverzadigde koolwaterstof.
Het aantal onverzadiging
Onverzadigde koolwaterstoffen worden gekenmerkt door het aantal onverzadiging. Dit geeft aan dat het aantal waterstofparen minder dan een onverzadigde koolwaterstof wordt vergeleken met een verzadigde die van hetzelfde aantal koolstofatomen bezit.
Het aantal onverzadiging kan worden berekend voor elke onverzadigde verbinding door middel van de volgende formule:
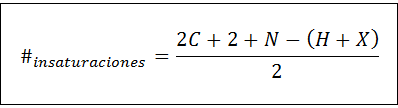
Waarbij c, n, h en x het aantal koolstofatomen, stikstof, hydrogenen en halogenen vertegenwoordigen in de moleculaire formule, respectievelijk. Dit aantal geeft ons een idee van hoeveel dubbels of drievoudige bindingen een verbinding hebben, gezien de moleculaire formule, hoewel zorg moet worden besteed omdat cycli (die geen onverzadiging zijn) ook bijdragen aan het aantal onverzadiging:

Voorbeeld
Benzeen heeft formule C6H6, Dus het aantal onverzadiging is:
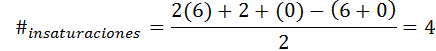
In dit geval komt de 4 onverzadiging overeen met drie dubbele links en een cyclus.
Classificatie van onverzadigde koolwaterstoffen
Volgens het type koolwaterstof
- Alkenes: Zij zijn degenen die ten minste één dubbele link in hun structuur hebben.
- Alkynes: Zij zijn degenen die ten minste één drievoudige link in hun structuur hebben.
- Aromatisch: Het zijn cyclische meervoudig onverzadigde verbindingen met speciale eigenschappen die ze bijzonder stabiel maken.
Volgens de koolstofketen
- Lineair: Onverzadigde verbindingen waarin alle koolstofatomen aan elkaar zijn gekoppeld in een enkele keten.
- Vertakt: Zij zijn degenen die een hoofdketen hebben en ook verschillende laterale ketens die gevolgen vormen.
- Cyclisch: Het zijn die waarin een gesloten cyclus van koolstofatomen wordt gepresenteerd waarin ten minste één dubbele of drievoudige binding wordt gepresenteerd (cycloalquenos, cycloalquinos en aromatisch).
Volgens het aantal onverzadiging
- Enkelvoudig onverzadigd: Als ze slechts een meervoudige link hebben, dat wil zeggen, is het een enkele dubbele binding of een enkele drievoudige link.
- Polynsatured: Wanneer de structuur meer dan één meervoudige link heeft, zoals in het geval van de Alkian, Alkian, Alkenins, enz.
Eigenschappen van onverzadigde koolwaterstoffen
De eigenschappen van onverzadigde koolwaterstoffen hangen sterk af van het specifieke type koolwaterstof in kwestie:
Fusie- en kookpunten
Over het algemeen hebben onverzadigde koolwaterstoffen lage fusie en kookpunten. In vergelijking met alkanen hebben alkenen met hetzelfde aantal koolstofatomen en een vergelijkbare hoofdketen echter meestal een lager kookpunt, terwijl alkines de neiging hebben om grotere kookpunten te hebben.
Hetzelfde geldt voor fusiepunten. In de volgende tabel is te zien dat zowel het fusiepunt als het koken van 1-penteen lager zijn dan die van de pentan en deze die van de 1-Pentino.

Fysieke staat
Vanwege de lage smelt- en kookpunten zijn onverzadigde laag molecuulgewicht gewicht koolwaterstoffen meestal gasvormig bij kamertemperatuur. Velen zijn ook vloeibaar en die van een groter molecuulgewicht zijn vast. In veel gevallen zijn vaste stoffen amorfe vaste stoffen in plaats van kristallijn.
Polariteit
Alle koolwaterstoffen, inclusief onverzadigde, zijn apolaire verbindingen, omdat koolstofelektronegativiteit en waterstof zeer vergelijkbaar zijn. De enige uitzondering is in het geval van terminale alkines2 en sp3.
Oplosbaarheid
Als apolair zijn onverzadigde koolwaterstoffen onoplosbaar in water en andere polaire oplosmiddelen, maar ze zijn zeer oplosbaar in apolaire oplosmiddelen zoals koolstoftetrachloride, cyclohexan en andere. In feite zijn veel van deze verbindingen op zichzelf apolaire oplosmiddelen.
Het kan u van dienst zijn: disposio: structuur, eigenschappen, verkrijgen, gebruikHet zijn brandstoffen
Een kenmerk van alle koolwaterstoffen, inclusief onverzadigde, is dat ze verbranden in aanwezigheid van zuurstof om koolstofdioxide te worden en water te maken die energie vrijgeven in de vorm van licht en warmte.
Ze kunnen polymeriseren
Door verschillende chemische reacties kunnen alkenen en alkines elkaar aansluiten om polymeren te vormen zoals in het geval van polyethyleen en polypropyleen, om slechts enkele te noemen. Dus onverzadigde koolwaterstoffen zijn het uitgangsmateriaal van veel gewone kunststoffen.
Chemische reactiviteit
De reactiviteit hangt sterk af van het type functionele groep met een molecuul. In het geval van alkenen en alkines zijn deze meestal vrij reactief en kunnen ze de reacties van hydrogenering, hydratatie, hydrohalogenering en andere soorten toevoegingsreacties.
Aan de andere kant zijn aromatische verbindingen meestal vrij inert omdat ze erg stabiel zijn. De karakteristieke reacties van deze verbindingen zijn de aromatische elektrofiele substitutiereacties.
Nomenclatuur van onverzadigde koolwaterstoffen
Nomenclatuur van alkenes
Lineaire alkenen
De naam van de lineaire alkenen wordt gebouwd door een voorvoegsel te plaatsen dat het aantal koolstofatomen in de keten aangeeft, gevolgd door de koolstoflocator waar de afzonderlijke dubbele binding begint met scripts van de rest van de naam en afgewerkt met het achtervoegsel _eno:
Voorvoegsellocalizer
- Voorbeeld:
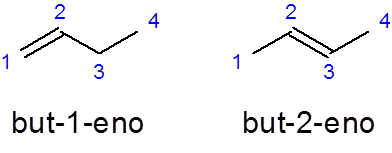
Hij But -1 -No Het is de naam van de lineaire buene met een dubbele binding in de eerste koolstof terwijl de But-2-negen Het heeft de dubbele binding in de tweede koolstof.
Vertakte alkenen
In het geval van vertakte alkenen is de langste hoofdketen die beide dubbele binding -koolstoffen bevat, eerst geselecteerd en is prioriteit voor de dubbele binding genummerd. De naam wordt eerst gebouwd door de gevolgen in alfabetische volgorde te plaatsen, voorafgegaan door de locators, gevolgd door de naam van de hoofdketen zoals hierboven aangegeven.
- Voorbeeld:
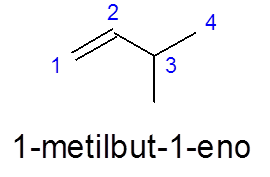
In het 3-methylbut-1 -N wordt de nummering van links naar rechts gedaan om prioriteit te geven aan de dubbele binding, in plaats van prioriteit te geven aan vertakking (de methylgroep).
Polyenen
In het geval van meervoudig onverzadigde of polienous alkenen, die meer dan één dubbele binding bevatten, wordt het grootste mogelijke aantal dubbele bindingen geselecteerd als de hoofdketen, ongeacht of er andere langere ketens zijn.
In de naam van de hoofdketen wordt een locator toegevoegd voor elke dubbele binding en het voorvoegsel di, tri, tetra, enz. vóór de beëindiging -NO, om het aantal dubbele links aan te geven dat u heeft.
- Voorbeeld:
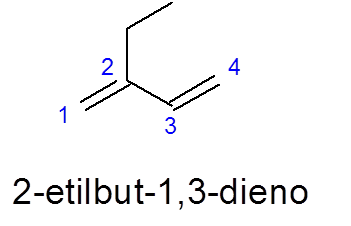
Merk in dit geval op dat ondanks het feit dat er een langere 5 -carbon ketting is, de 4 van 4 is geselecteerd, omdat deze de twee dubbele links bevat.
Nomenclatuur van de Alquinos
De alkynes worden zeer op de alkenen genoemd, met het enige verschil dat de naam eindigt in -ino in plaats van -Eno. In gevallen waarin er meer dan één drievoudige link is, worden de locators van allemaal geplaatst en het numerieke voorvoegsel dat aangeeft hoeveel er zijn.
- Voorbeeld:
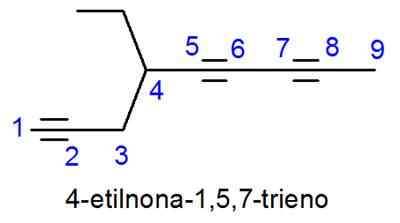
Nomenclatuur van aromatische verbindingen
Aromatische koolwaterstoffen worden benoemd als benzeenderivaten en zowel de nummering als de manier om ze te benoemen hangt af van hoeveel substituenten de ring hebben.
Aromatische ringen met een enkele substituent
In dit geval is het niet nodig. De naam bestaat uit de naam van de tak gevolgd door het woord benzeen.
- Voorbeeld:
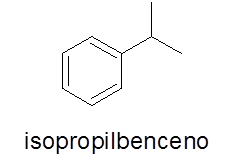
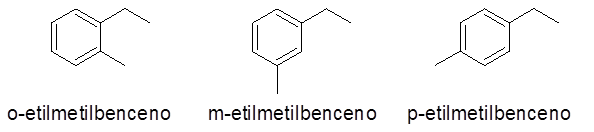
Aromatische ringen met twee substituenten
In dit geval kunnen 3 getallen of vervangingspatronen worden gegeven (1.2), (1.3) en (1,4). Omdat het onverschillig is om aan te geven welke vervanger zich in koolstof 1 bevindt en in de andere, ortho-voorvoegsels (O-), meta- (m-) en para- (p-), om naar hetzelfde te verwijzen.
- Voorbeelden:
Aromatische ringen met meer dan 2 substituenten
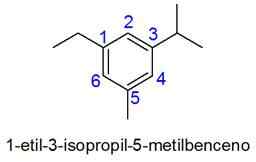
In dit geval is de nummering van de kleinste combinatie van locators geselecteerd. Als twee getallen gelijk zijn, wordt prioriteit gegeven aan substituenten volgens de alfabetische volgorde.
- Voorbeelden:
Voorbeelden van onverzadigde koolwaterstoffen
Vervolgens worden aanvullende voorbeelden van onverzadigde koolwaterstoffen gepresenteerd aan die reeds genoemde.
Acetyleen (c2H2))
Acetyleen is de gemeenschappelijke naam van de Etino, de eenvoudigste alchemine. Deze verbinding heeft 2 onverzadiging vanwege de drievoudige link en wordt onder andere gebruikt in de staal- en lasapparatuur.
Cyclohexen (c6H10))
6 -koolstofcyclische alkeen die twee onverzadiging heeft: één vanwege de cyclus en de andere vanwege de dubbele binding.
Stretch (c8H8))
Deze verbinding wordt vaak gebruikt in de voorbereiding van polymeren. Het is een aromatisch alkeen met 5 onverzadiging.

