Alifatische koolwaterstoffen eigenschappen, nomenclatuur, reacties, typen

- 1204
- 76
- Irving McClure I
De Alifatische koolwaterstoffen Het zijn allemaal degenen die geen aromaticiteit hebben, niet in reukzin, maar met betrekking tot chemische stabiliteit. Het classificeren van koolwaterstoffen op deze manier is vandaag te dubbelzinnig en onnauwkeurig, omdat het niet discrimineert tussen verschillende soorten koolwaterstoffen die niet aromatisch zijn.
We hebben dus alifatische koolwaterstoffen en aromatische koolwaterstoffen. De laatste worden herkend door hun basiseenheid: de Benncénico -ring. De anderen daarentegen kunnen elke moleculaire structuur overnemen: lineair, vertakt, cyclisch, onverzadigd, polycyclisch; Zolang ze geen geconjugeerde systemen zoals benzeen hebben.
 De vloeibare brandstof van de aanstekers bestaat uit een mengsel van alifatische koolwaterstoffen. Bron: Pixnio.
De vloeibare brandstof van de aanstekers bestaat uit een mengsel van alifatische koolwaterstoffen. Bron: Pixnio. De term 'alifatisch' werd geboren uit het Griekse woord 'Aleiphar', wat vet betekent, ook gebruikt om te verwijzen naar oliën. Daarom werd in de negentiende eeuw deze classificatie toegewezen aan de koolwaterstoffen verkregen uit de olieachtige extracten; Terwijl aromatische koolwaterstoffen werden geëxtraheerd uit boom en geurige harsen.
Naarmate de basis van de geconsolideerde organische chemie echter werd ontdekt dat er een chemische eigenschap was die gedifferentieerde koolwaterstoffen, nog belangrijker was dan hun natuurlijke bronnen: aromaticiteit (en geen geur).
Op deze manier hielden alifatische koolwaterstoffen op alleen die verkregen uit vetten te zijn, als al diegenen die aromaticiteit missen. Binnen deze familie hebben we alkenen en alkynes, ongeacht of ze lineair of cyclisch zijn. Dat is de reden waarom 'alifatisch' als onnauwkeurig wordt beschouwd; Hoewel het handig is voor het aanpakken van enkele algemene aspecten.
Wanneer bijvoorbeeld 'uitersten' of 'ketens' alifatisch worden gezegd, worden moleculaire gebieden verwezen naar waar aromatische ringen afwezig zijn. Van alle alifatische koolwaterstoffen is de eenvoudigste per definitie methaan, cho4; Terwijl benzeen de eenvoudigste van aromatische koolwaterstoffen is.
[TOC]
Eigenschappen van alifatische koolwaterstoffen
De eigenschappen van alifatische koolwaterstoffen oscilleren in verschillende graden, afhankelijk van welke in overweging worden genomen. Er zijn lage en hoge moleculaire massa's, evenals lineair, vertakt, cyclisch of polycyclisch, zelfs die van verbazingwekkende drie -dimensionale structuren; Zoals bij de Cubaan, in de vorm van een kubus.
Er zijn echter enkele algemeenheden die kunnen worden vermeld. De meeste alifatische koolwaterstoffen zijn hydrofobe en apolaire gassen of vloeistoffen, met wat meer apolair dan andere, omdat zelfs die in wiens koolstofketens halogeen, zuurstof, stikstof of zwavelatomen hebben opgenomen in de lijst.
Kan u van dienst zijn: BORON: Geschiedenis, eigenschappen, structuur, gebruikHet zijn ook ontvlambare verbindingen, omdat ze vatbaar zijn voor oxideren in de lucht vóór een minimale warmtebron. Deze functie wordt gevaarlijker als we de hoge volatiliteit toevoegen, vanwege de zwakke dispersieve interacties die alifatische moleculen samenhangend behouden.
We zien het bijvoorbeeld in de butaan, een gas dat zowel relatief gemak als propaan kan worden gevoerd. Beide zijn erg vluchtig en brandbaar, dus het zijn actieve componenten van keukengas of pocket aanstekers.
Natuurlijk heeft een dergelijke volatiliteit de neiging om af te nemen, omdat de moleculaire massa en koolwaterstof steeds meer viskeuze vloeistoffen veroorzaakt.
Nomenclatuur
De nomenclatuur van koolwaterstoffen verschilt zelfs meer dan zijn eigenschappen. Als het alko of alkines zijn, worden dezelfde normen die door de IUPAC worden bepaald, gevolgd: selecteer de langste ketting, de laagste indicatoren toewijzen aan het meest vervangen uiteinde of aan de heteroatomen of meer reactieve groepen.
Op deze manier weet u op welke koolstof elke substituent wordt gevonden, of zelfs onverzadiging (dubbele of drievoudige links). In het geval van cyclische koolwaterstoffen wordt de naam voorafgegaan door de substituenten die in alfabetische volgorde worden vermeld, gevolgd door het woord 'cyclus', waarbij de koolstofaantallen worden geteld die het integreren.
Overweeg bijvoorbeeld de volgende twee cyclohexans:
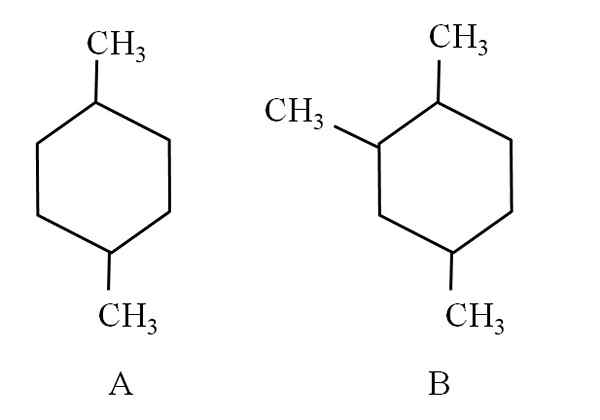 Twee cyclohexans, die zijn geclassificeerd als alifatische koolwaterstoffen. Bron: Gabriel Bolívar.
Twee cyclohexans, die zijn geclassificeerd als alifatische koolwaterstoffen. Bron: Gabriel Bolívar. Cyclohexan A, wordt 1.4-dimethylciclohexan genoemd. Als de ring vijf koolstofatomen was, zou dit 1.4-dimethylciclopentano zijn. Ondertussen wordt de Cylohexan B 1,2,4-trimethylcyclohexan genoemd, en niet 1,4,6-cyclohexan, omdat het de laagste indicatoren wil gebruiken.
Nu kan de nomenclatuur erg ingewikkeld worden voor operabotische structuren koolwaterstoffen. Voor hen zijn er meer specifieke regels, die afzonderlijk en zorgvuldig moeten worden uitgelegd; Zoals bij de doelen, terpenen, beleid en de polycyclische verbindingen.
Reacties
Verbranding
Gelukkig zijn reacties minder gevarieerd voor deze koolwaterstoffen. Een van hen werd al genoemd: ze verbranden gemakkelijk, produceerden koolstofdioxide en water, naast andere oxiden of gassen, afhankelijk van de aanwezigheid van heteroatomen (CL, N, P, O, enz.)). Maar de CO2 en h2Of zijn de belangrijkste verbrandingsproducten.
Toevoeging
Als ze onverzadiging hebben, kunnen ze aanvullende reacties lijden; dat wil zeggen, ze nemen kleine moleculen in hun skelet op als substituenten na een specifiek mechanisme. Onder deze moleculen hebben we dat van water, waterstof en halogenen (F2, Klet2, BR2 en ik2)).
Halogenering
Aan de andere kant, alifatische koolwaterstoffen onder de incidentie van ultraviolette straling (HV) en warmte kunnen C-H-koppelingen breken om ze te wijzigen door C-X-links (C-F, C-Cl, etc.)). Dit is de halogenatiereactie, die wordt waargenomen in alkanen met zeer korte keten, zoals methaan of pentan.
Kan u van dienst zijn: nitrieten: eigenschappen, structuur, nomenclatuur, vormingCraqueo
Een andere reactie die alifatische koolwaterstoffen kunnen lijden, vooral alkanen met lange keten, is thermisch barsten. Het bestaat uit de levering van intense warmte zodat de thermische energie de C-C-bindingen verbreekt, en dus worden kleine moleculen, meer geciteerd in de brandstofmarkt, uit grote moleculen gevormd.
De vier reacties hierboven zijn de belangrijkste die een alifatische koolwaterstof kunnen ondergaan, waarbij de verbranding de belangrijkste van allemaal is, omdat deze geen enkele verbinding onderscheidt; Allen zullen branden in de aanwezigheid van zuurstof, maar niet iedereen zal moleculen toevoegen of in kleine moleculen breken.
Jongens
Alifatische koolwaterstoffen groep eindeloze verbindingen, die op hun beurt specifieker worden geclassificeerd, wat de mate van hun onverzadiging aangeeft, evenals het type structuur dat ze hebben.
Volgens hoe onverzadigd ze zijn, hebben we de alkanen (verzadigd), alkenen en alkynes (onverzadigd).
De alkanen worden gekenmerkt door eenvoudige C-C-links te hebben, terwijl we in alkenen en alkines respectievelijk links C = C en C≡C waarnemen. Een zeer algemene manier om ze te visualiseren is om na te denken over de koolstofkeletten van de alkanen als zigzagen en gevouwen ketens, "vierkant" voor alkenen en "rechte lijnen" voor alkines.
Dit komt omdat de dubbele en drievoudige bindingen energie en stenrische beperking hebben in hun rotaties, hun structuren "verharden".
Alkito's en alkines kunnen worden vertakt, cyclisch of polycyclisch. Dat is de reden waarom cycloalcanos, cycloalquenos, cycloalquinos en verbindingen zoals decaline (fietsstructuur), adamantano (vergelijkbaar met een honkbalkap), heptaleen, gonano, onder andere, alifatische koolwaterstoffen worden overwogen, worden ook overwogen.
Uit alkenen ontstaan andere soorten koolwaterstoffen, zoals de doelen (met twee dubbele bindingen), polienous (met veel dubbele alternatieve bindingen) en terpenen (verbindingen afgeleid van het isopreen, een Diene).
Toepassingen
Nogmaals, gebruik voor deze koolwaterstoffen kan variëren, afhankelijk van welke wordt overwogen. In de secties van eigenschappen en reacties werd echter duidelijk gemaakt dat alle verbranding, niet alleen om gasmoleculen af te geven, maar ook licht en warmte. Het zijn dus energiereservoirs, nuttig om te dienen als brandstoffen of warmtebronnen.
Dat is de reden waarom ze worden gebruikt als onderdeel van de samenstelling van benzine, voor aardgas, in bunsen -aanstekers en in het algemeen om vuur te kunnen ontstaan.
Kan u van dienst zijn: octetregelEen van de meest opmerkelijke voorbeelden is die van acetyleen, HC≡CH, waarvan de verbranding het mogelijk maakt om de metaalionen van een monster in de atomaire absorptiespectrometrie te opwinden die op analytische tests worden uitgevoerd. Evenzo kan het resulterende vuur worden gebruikt voor lassen.
Vloeibare alifatische koolwaterstoffen, zoals paraffinica, worden vaak gebruikt als oplosmiddelen voor vetextractie. Bovendien kan de oplosmiddelactie worden gebruikt om vlekken, email, schilderijen of gewoon om oplossingen van een specifieke organische verbinding te maken.
De grootste moleculaire massa, al viskeus of vast, is bestemd voor de uitwerking van harsen, polymeren of medicijnen.
Met betrekking tot de term 'alifatisch' wordt het meestal gebruikt om te verwijzen naar die regio's, in een macromolecuul, die aromaticiteit missen. Asfaltenen worden bijvoorbeeld oppervlakkig beschreven als een aromatische kern met alifatische ketens.
Voorbeelden
In het begin werd gezegd dat methaan de eenvoudigste van alifatische koolwaterstoffen is. Ze worden gevolgd door propaan, cho3Ch2Ch3, Butano, ch3Ch2Ch2Ch3, Pentano, Ch3Ch2Ch2Ch2Ch3, Octane, Nonano, Dean, enzovoort, met steeds meer lange alkanes.
Hetzelfde geldt voor ethyleen, cho2= Ch2, Propeno, ch3CH = CH2, Buteno, ch3Ch2CH = CH3, En voor de rest van de alkines. Als er twee dubbele bindingen zijn, zijn ze Oley, en als er meer dan twee, poliena's zijn. Evenzo kunnen er dubbele en drievoudige links zijn in hetzelfde skelet, waardoor de structurele complexiteit toeneemt.
Onder de cycloalcanos kunnen we de cyclopropaan, cyclobutaan, cyclopentano, cyclohexan, cycloheptano, cycloctaan, evenals cyclohexen vermelden. Van al deze koolwaterstoffen worden vertakte derivaten verkregen, waardoor de beschikbare voorbeelden verder worden vermenigvuldigd (zoals 1,4-dimethylciclohexano).
Van de meest representatieve terpenen hebben we limoneen, mentol, pineen, vitamine A, escualeno, enz. Polyethyleen is een verzadigd polymeer met eenheden -ch2-Ch2-, Het is dus ook een voorbeeld van deze koolwaterstoffen. Andere voorbeelden zijn al in de vorige paragrafen aangehaald.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Helmestine, Anne Marie, pH.D. (22 augustus 2019). Alifatische koolwaterstofdefinitie. Hersteld van: Thoughtco.com
- Wikipedia. (2019). Alifatische verbinding. Opgehaald uit: in.Wikipedia.borg
- Chemistry Libhethexts. (20 augustus 2019). Alifatische koolwaterstoffen. Hersteld van: chem.Librhetxts.borg
- Elizabeth Wyman. (2019). Alifatische koolwaterstoffen: definitie en eigenschappen. Studie. Hersteld van: studie.com
- « Sociale dimensie is menselijk, onderwijs, kennis, recht, gezondheid
- 100 nieuwsgierige dierengegevens »

