Hydrolyse wat bestaat en voorbeelden van reacties
- 3607
- 290
- James Dach
De hydrolyse Het is een chemische reactie die kan optreden in zowel anorganische als organische moleculen of ionen, en die betrekking heeft op de deelname van water voor de afbraak van zijn bindingen. Zijn naam is afkomstig van het Griekse, 'Hydro' van water en 'lysis' van breuk.
Het watermolecuul, h2Of het vestigt een evenwicht met de ionen van zure zouten en zwakke basen, die voor het eerst dit concept verschijnen in algemene studies van chemie en in analytische chemie. Het is daarom een van de eenvoudigste chemische reacties.
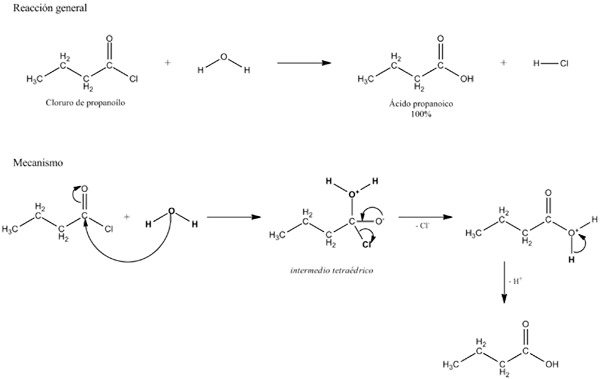
 Algemene vergelijking voor een hydrolysereactie. Bron: Gabriel Bolívar.
Algemene vergelijking voor een hydrolysereactie. Bron: Gabriel Bolívar. In verschillende voorbeelden van hydrolyse is water alleen niet in staat om een bepaalde covalente binding te verbreken. Wanneer dit gebeurt, versnelt het proces of katalyseert of katalyseert door verzuring of alkalisatie van het medium; dat wil zeggen in aanwezigheid van H -ionen3OF+ of oh-, respectievelijk. Er zijn ook enzymen die hydrolyse katalyseren.
Hydrolyse neemt een speciale plaats in in termen van biomoleculen, omdat de banden die hun monomeren bij elkaar houden, vatbaar zijn voor hydrolysar onder bepaalde omstandigheden. Suikers worden bijvoorbeeld gehydrolyseerd om polysachariden in hun samenstellende monosachariden te ontbinden dankzij de werking van glucosidase -enzymen.
[TOC]
Wat is hydrolyse?
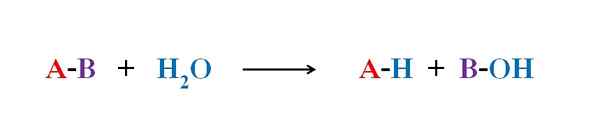
Het bovenste beeld legt uit waar hydrolyse uit bestaat. Merk op dat niet alleen het molecuul of het substraat (als ze enzymen bemiddelen) hun schakel verbreekt, maar ook het water zelf, dat "breuk" is in h+ en oh-, Waar h+ eindigt met een, en oh- met B. A-B reageert met een watermolecuul uit twee producten, A-H en B-OH.
Hydrolyse is daarom de reactie die in strijd is met condensatie. In de condensatie worden twee producten, om te zeggen A-H en B-OH, binden door de afgifte van een klein molecuul: water. Bij hydrolyse wordt een molecuul geconsumeerd, terwijl het in condensatie wordt vrijgegeven of geproduceerd.
Het kan u van dienst zijn: carbonylgroep: kenmerken, eigenschappen, nomenclatuur, reactiviteitTerugkerend naar het voorbeeld van suikers, stel dat A-B overeenkomt met een sucrose-dimeer, waar hij glucose vertegenwoordigt, en B-fructose. De A-B, glucosidische link kan hydrolyseren om de twee monosachariden afzonderlijk en in oplossing te ontstaan, en hetzelfde gebeurt met de oligo- en polysachariden als ze enzymen in dergelijke reacties bemiddelen.
Merk op dat in deze reactie, die van A-B, de pijl slechts één adres heeft; dat wil zeggen, het is een onomkeerbare hydrolyse. Veel hydrolyse zijn echter in feite omkeerbare reacties die een evenwicht bereiken.
Voorbeelden van hydrolysereacties
- ATP
De ATP is stabiel tussen pH -waarden van 6,8 en 7,4. Bij extreme pH -waarden wordt het echter spontaan gehydrolyseerd. In levende wezens wordt hydrolyse gekatalyseerd door enzymen die bekend staan als Atasas:
ATP +H2O => ADP +PI
Deze reactie is sterk exergonisch, omdat de entropie van ADP groter is dan die van ATP. Gibbs vrije energievariatie (ΔGº) is - 30,5 kJ/mol. De energie geproduceerd door ATP -hydrolyse wordt gebruikt in tal van Endergon -reacties.
Gekoppelde reacties
In sommige gevallen wordt ATP -hydrolyse gebruikt voor de omzetting van een verbinding in een verbinding (B).
A +ATP +H2Of B +ADP +PI +H+
- Water
Twee watermoleculen kunnen op elkaar reageren in een schijnbare hydrolyse:
H2Of + h2Of h3OF+ + Oh-
Het is alsof een van die watermoleculen is gebroken in h+ en oh-, Ik ga de h koppelen+ Naar het zuurstofatoom van het andere watermolecuul, dat het hydriumion veroorzaakt, h3OF+. Deze reactie, meer dan hydrolyse, gaat over de zelfpropotolyse van water.
Kan u van dienst zijn: activeringsenergie- Eiwitten
Eiwitten zijn stabiele macromoleculen en om hun volledige hydrolyse te bereiken, in de aminozuren die deze vormen, zijn extreme omstandigheden vereist; zoals een concentratie zoutzuur (6 m) en hoge temperaturen.
Levende wezens zijn echter begiftigd met een enzymatisch arsenaal dat de hydrolyse van eiwitten in aminozuren in de twaalfvingerige darm mogelijk maakt. De enzymen die betrokken zijn bij eiwitvertering worden bijna volledig uitgescheiden door de alvleesklier.
Er zijn exopeptidase -enzymen die eiwitten afbreken, beginnend aan hun uiteinden: aminopeptidase door het amino -uiteinde en carboxypeptidase door het carboxyluiteinde. Endopeptidase -enzymen oefenen hun werking uit in de eiwitketen, bijvoorbeeld: Tripsin, pepsine, chimotrips, enz.
- Amidas en esters
De amiden wanneer verwarmd in een alkalisch medium zijn een carbonzuur en een amine afkomstig:
Rconh2 + H2O => rcoo- + NH2
Vast in een waterig medium worden gehydrolyseerd in een carbonzuur en alcohol. Het proces wordt gekatalyseerd door een basis of een zuur:
Rco-or ' +h2O => RCOOH +R'OH
Dit is de beroemde verzepingsreactie.
- Zuur-base
In het water worden verschillende soorten gehydrolyseerd om de waterige omgeving te verzuren of alkaliseren.
Toevoeging van een basiszout
Natriumacetaat, een basiszout, dissocieert in water die na ionen geeft+ (natrium) en cho3Coo- (acetaat). De basiciteit is omdat acetaat wordt gehydrolyseerd om ionen te genereren oh-, Terwijl natrium ongewijzigd blijft:
Ch3Coo- + H2Of ch3COOH +OH-
Het kan u van dienst zijn: methylsalicylaatOH- Hij is verantwoordelijk voor de pH om te verhogen en fundamenteel te worden.
Toevoeging van een zuurzout
Ammoniumchloride (NH4Cl) wordt gevormd door het chloride -ion (CL-) van zoutzuur (HCL), een sterk zuur en het ammoniumkation (NH4+) van ammoniumhydroxide (NH4Oh), een zwakke basis. De Cl- Het dissocieert niet in water, maar het ammoniumkation wordt op de volgende manier in het water getransformeerd:
NH4+ + H2Of NH3 + H3OF+
De hydrolyse van het ammoniumkation produceert protonen die de zuurgraad van een waterig medium verhogen, dus wordt geconcludeerd dat de NH4CL is een zuurzout.
Toevoeging van een neutraal zout
Natriumchloride (NaCl) is een zoutproduct van de reactie van een sterke basis (NaOH) met een sterk zuur (HCl). Bij het oplossen van natriumchloride in het water wordt het natriumkation geproduceerd (NA+) en het anion (Cl-)). Beide ionen dissociëren niet in het water, dus voegen ze niet toe h+ of oh-, Uw pH constant houden.
Daarom wordt gezegd dat natriumchloride een neutraal zout is.
Referenties
- Mathews, c. K., Van Holde, K. EN. En ahern, k. G. (2002). Biochemie. (Derde editie). Bewerking. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Helmestine, Anne Marie, pH.D. (13 januari 2019). Hydrolyse: definitie en voorbeeld. Hersteld van: Thoughtco.com
- Theresa Phillips. (28 april 2019). Een verklaring van het hydrolyseproces. Hersteld van: Thalance.com
- De redacteuren van Enyclopaedia Britannica. (16 november 2016). Hydrolyse. Encyclopædia Britannica. Hersteld van: Britannica.com
- Wikipedia. (2019). Hydrolyse. Opgehaald uit: in.Wikipedia.borg
- « Hyracotherium -kenmerken, voeding, soort, reproductie
- History of Origins videogames naar virtual reality »

