Hydrazinestructuur, eigenschappen, synthese, gebruik

- 4960
- 1150
- Dewey Powlowski
De Hydrazine Het is een anorganische verbinding waarvan de chemische formule is n2H4. Het bestaat uit een lid van de familie van stikstofhydroren, de eenvoudigste is de eenvoudigste van allemaal zijn. Hoewel het molecuul eenvoud lijkt, vertoont het verschillende chemische en fysische eigenschappen die van hydrazine een interessante en energetisch veelbelovende stof maken.
Houd een nauwkeurigheid met water, omdat beide bestaan als vloeibare stoffen in vergelijkbare temperaturen intervallen. Van hydrazine kunnen we organische derivaten verkrijgen door de hydrogenen te vervangen door koolzuurhoudende groepen. Ook daarvan gesynthetiseerde hydrazons, hydraziden en hydrazinezouten.
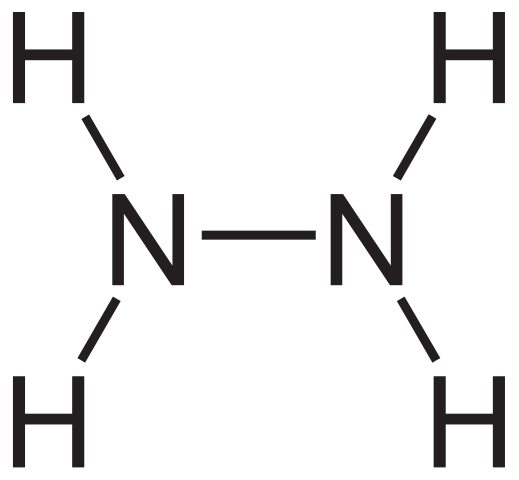 Hydrazine structurele formule. Bron: Neurotoger via Wikipedia.
Hydrazine structurele formule. Bron: Neurotoger via Wikipedia. De structurele formule van hydrazine is hierboven te zien, die kan worden geschreven als h2Nnh2 of h2NH2. Als je goed kijkt, lijkt het erop dat twee NH -moleculen3 Ze zouden aan elkaar hebben gekoppeld. Bij de vorming van de N-N-link is echter niet alleen ammoniakmoleculen als reagentia betrokken.
Hydrazine is een verbinding met meerdere toepassingen, omdat het een uitstekende voorloper is voor symfines van verbindingen, zowel organisch als anorganisch. Evenzo is het dankzij de reducerende kracht en zijn ontledingsproducten bestemd om zuurstof en andere gassen te elimineren, edelmetalen te verkrijgen; En vooral om ruimtevaartuigen en staat -van -de -art vliegtuigen te stimuleren.
[TOC]
Hydracinestructuur
Molecuul en link
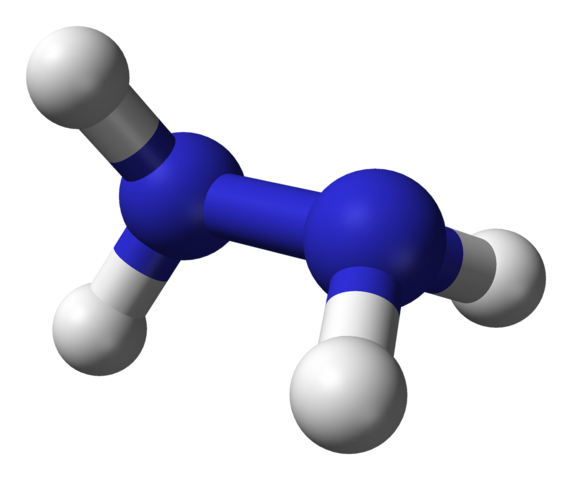 Moleculaire structuur van hydrazine. Bron: Ben Mills via Wikipedia.
Moleculaire structuur van hydrazine. Bron: Ben Mills via Wikipedia. In het bovenste beeld hebben we het hydrazinemolecuul voorgesteld door een bollen en barsmodel. Merk op dat de ruimtelijke oriëntatie van waterstofatomen, witte bollen, contrasteert met de indruk die wordt aangeboden door de structurele formule; dat wil zeggen, de hydrogenen van beide -nh2 Ze zijn niet uitgelijnd of overschaduwd, maar hebben een rotatiehoek van 95º met elkaar.
In feite is het zozeer dat de N-N-link nauwelijks kan roteren, met een energiebarrière die moet worden verlopen om de vier waterstofatomen te verdoven.
Waar gaat dit over? In principe, tot sterke elektronische afstotingen die de twee paren solitaire elektronen op stikstofatomen onderling ervaren. Deze hoek van 95º is degene die het hydrazinemolecuul de grootste stabiliteit geeft.
Kan u van dienst zijn: lithiumbromide: structuur, eigenschappen, gebruik, risico'sGeometrieën
Elk stikstofatoom heeft een SP -hybridisatie3, Een driehoekige piramide -geometrie aannemen. Daarom konden met de vrije elektronenparen het hycinemolecuul zoals twee piramides verbonden door een van de hoekpunten worden gevisualiseerd, en in wiens centra de stikstofatomen zouden worden gevonden.
Intermoleculaire interacties
De formule h2Nnh2 Ik zou het valse idee kunnen geven dat hydrazine een apolaire verbinding is voor het hebben van twee gelijke groepen met elkaar verbonden. De moleculaire structuur en de geroteerde N-N-binding laten echter zien dat het molecuul niet volledig symmetrisch is, en vermeldt ook dat hun vrije elektronenparen niet in tegengestelde richtingen wijzen.
Dit betekent dat hydrazine, structureel en elektronisch asymmetrisch is, een dipoolmoment presenteert. En daarom interageren hun moleculen met elkaar via dipool-dipol2Nnh2-NH2NH2, die verantwoordelijk zijn voor hydrazine met een zeer hoog kookpunt.
Hycin -eigenschappen
 Hydrazinehydraat. Bron: lhchem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Hydrazinehydraat. Bron: lhchem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) Fysiek uiterlijk
Hydrazine is een kleurloze vloeistof vergelijkbaar met water met betrekking tot viscositeit en dichtheid. Wanneer het verbrand is, zendt het witte dampen uit, naast het verkrijgen van ammoniak en vis.
Molaire massa
32.0452 g/mol
Smeltpunt
2 ºC.
Kookpunt
114 ºC. Merk op dat hydrazine bestaat in een vloeibare toestand binnen het temperatuurinterval 2-114 ºC, zeer vergelijkbaar met die van water, 0-100 ºC.
Dikte
1.021 g/cm3
Stoomdichtheid
1.1 in luchtrelatie.
Dampdruk
Ongeveer 0.010 ATM op 30.7 ºC
Oplosbaarheid
Hydrazine is mengbaar met water, evenals met verschillende primaire alcoholen. Hydrazine vormt een hydraat met water, n2H4· H2Of, die wordt gekenmerkt door dichter te zijn dan puur of watervrij hydrazine. Dit hydraat is het meest op de markt gebrachte product, omdat het stabieler en goedkoop is.
Dipolair moment
1.85 d. Het is een nogal polaire stof, bijna hetzelfde als water.
Het kan u van dienst zijn: Yodiumzuur (HIO3): structuur, eigenschappen, risico's en gebruikSmurrie
0.876 CP
Flitspunt
52 ºC
Zelf -richtingtemperatuur
Varieert afhankelijk van de stoffen of oppervlakken waarmee het in contact komt. Op ijzeroxiden brandt bijvoorbeeld bij 23 ° C, terwijl op glas of andere containers niet ontstoken wordt tot 270 ºC.
Ontleding
Wanneer het in de lucht brandt, ontleedt het in stikstofoxiden, neeX. Maar wat betreft de katalytische ontleding, dat wil zeggen dat versneld door metaaloxiden of metaal, producten zoals ammoniak, stikstof en waterstof worden verkregen, en een enorme hoeveelheid warmte, die uiteindelijk een brandende maar onzichtbare vlam vormen.
Reactiviteit
Hydrazine is een goed reductiemiddel, omdat wanneer geoxideerd water en stikstof produceert, beide verbindingen die geen secundaire reacties lijden.
Aan de andere kant is hydrazine een nucleofiel, omdat het zijn vrije elektronenparen gebruikt om zich bij andere organische moleculen aan te sluiten. Evenzo kan het lijden vervangen3, Om gemethyleerde derivaten te produceren: ch3Nhnh2 of (ch3))2Nnh2.
Reageert met sterke zuren om Hidrazinio -zouten te vormen, n2H5X, en uit Hidrazonio, n2H6X2. De laatste komt het minst voor. Hydraziniumsulfaat, [n2H5] HSO4, Het wordt bereid door hydrazinehydraat te reageren met zwavelzuur.
Basiciteit
Hydrazine is een zwakkere basis dan ammoniak:
N2H4(AC) + H2Of (l) ⇌ n2H5+(AC) + OH-(AC)
KB = 1.3 · 10-6
Dit komt omdat hydrazinio conjugaatzuur2H5+ of h3N+-NH2, heeft zijn belasting gedestabiliseerd door het attractoreffect van de NH -groep2; dat wil zeggen, in plaats van de elektronische dichtheid te bieden aan positieve stikstof, de intrekking.
Hydrazine is in staat om een tweede, veel minder waarschijnlijke protonatie te lijden, wat een nog onstabiel geconjugeerd zuur genereert:
N2H5+(AC) + H2Of (l) ⇌ n2H6+(AC) + OH-(AC)
KB = 8.4 · 10-16
Het hydrazonium, n2H6+ of h3N+-N+H3, Het is zeer onstabiel vanwege de afstotingen tussen de positieve belastingen van beide stikstofatomen. In het gezelschap van bepaalde anionen kan het echter als zout bestaan.
Toxiciteit
Anhydra -hydrazine is een extreem giftige, bijtende en mogelijk carcinogene substantie, en niet te vergeten dat het zeer explosief is, dus het moet alleen worden gemanipuleerd onder strikte beveiligingsprotocollen.
Kan u van dienst zijn: samendrukbaarheidsfactor: hoe u kunt berekenen, voorbeelden en oefeningenSynthese
De meest gebruikte methode om hydrazine te synthetiseren is het Raschig -proces. Dit bestaat uit de volgende twee reacties:
NH3(AC) + NaOCL (AC) → NH2CL (AC) + NaOH (AC)
2nh3(AC) + NH2CL (AC) → N2H4(AC) + NH4CL (AC)
Uiteindelijk wordt de hydraat n gevormd2H4· H2Of, die wordt gedistilleerd in aanwezigheid van KOH of NaOH als droge vaste stoffen:
N2H4· H2O → n2H4
Op deze manier wordt het anhydra-hydrazine verkregen en wordt de N-N-link gevormd.
Hydrazine -gebruik
 Hydrazine is een van de meest gewaardeerde stoffen in de ruimtevaartboom. Bron: Pxhere.
Hydrazine is een van de meest gewaardeerde stoffen in de ruimtevaartboom. Bron: Pxhere. - Hydrazine is, in aanwezigheid van metalen katalysatoren, exotermisch afgebroken om stikstof en waterstof te produceren, waardoor er voldoende energie wordt geboden om vliegtuigen, raketten en satellieten te stimuleren.
- Deze neiging om af te breken en gassen te veroorzaken, wordt juist gebruikt om polymere materialen, zoals rubber of polyethyleen, op te blazen, waardoor ze in hun respectieve schuimen worden veranderd.
- Evenzo kunnen deze door het vrijgeven van gassen anderen slepen die worden opgelost in buizen van de leidingen, dus het is zeer nuttig om zuurstof uit ketels te verwijderen, waardoor ze worden vermeden dat ze corroderen.
- Hydrazine is een voorlopermateriaal voor veel organische verbindingen met farmacologische functies, antischimmels, herbiciden, insecticiden, meststoffen, enz. Dit komt door een breed scala aan cyclische stikstofderivaten worden gesynthetiseerd.
- Ten slotte worden een goed reductiemiddel, hydrazine en zijn hydraziniumzouten gebruikt om edelmetaalmineralen te verminderen, die van grote waarde zijn in de metallurgische industrie.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Hydrazine. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Hydrazine. PubChem Comunund Samenvatting voor CID 9321. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- De redacteuren van Enyclopaedia Britannica. (2020). Hydrazine. Britannica Encyclopaedia. Hersteld van: Britannica.com
- Iridium Volgende. (20 juni 2017). Hydrazine - giftig voor mensen, maar satellieten zijn er dol op. Hersteld van: iridium.com
- « De 95 beste zinnen van de Walking Dead
- Bassin -onafhankelijkheid veroorzaakt, ontwikkeling, gevolgen »

