Chemische hybridisatie

- 2061
- 543
- Glen Armstrong
Wat is chemische hybridisatie?
De Chemische hybridisatie Het is het "mengsel" van atomaire orbitalen, wiens concept in 1931 door de chemicus Linus Pauling werd geïntroduceerd om de onvolkomenheden van Valencia's Link Theory (TEV) te dekken. Welke onvolkomenheden? Dit zijn: moleculaire geometrieën en equivalente verbindingen in moleculen zoals methaan (CH4)).
Volgens de TEV vormen in methaan in methaan de atomaire orbitalen van C vier σ -banden met vier H -atomen. De orbitalen 2p, met vormen van ∞ (onderste afbeelding) van de C staan loodrecht op elkaar, dus de h moeten van elkaar worden verwijderd onder een hoek van 90º.

Bovendien is het 2S (sferisch) orbitaal. Experimenteel is echter gebleken dat de hoeken in de CH4 Ze zijn 109,5º en dat bovendien de lengtes van de C-H-verbindingen equivalent zijn.
Om dit uit te leggen, moet een combinatie van originele atoomorbitalen worden beschouwd als vier gedegenereerde hybride orbitalen (van gelijke energie). Hier komt chemische hybridisatie in het spel. Hoe zijn hybride orbitalen? Het hangt af van de atomaire orbitalen die ze genereren. Ze vertonen ook een mengsel van de elektronische kenmerken hiervan.
SP3
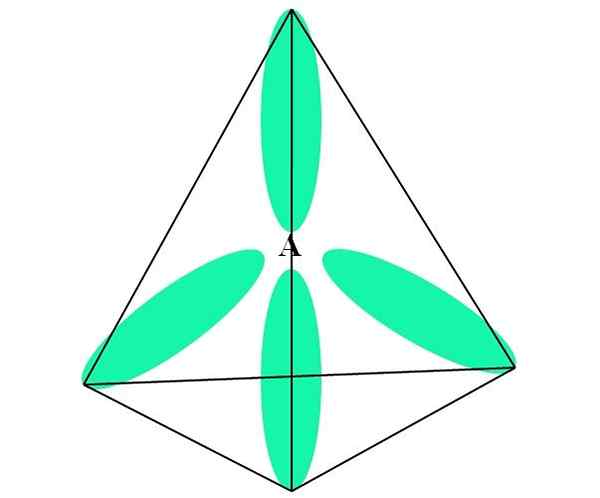
In het geval van CH4, C hybridisatie is sp3. Uit deze benadering wordt moleculaire geometrie uitgelegd met vier SP -orbitalen3 gescheiden op 109,5º en wijzend naar de hoekpunten van een tetraëder.
In de bovenste afbeelding kunt u zien hoe de orbitalen sp3 (groen) Stel een tetraëdrische elektronische omgeving op rond het atoom (A, dat is C voor CH4)).
Kan u van dienst zijn: aminesWaarom 109.5º en niet andere hoeken, om een andere geometrie te "tekenen"? De reden is te wijten aan het feit dat deze hoek de elektronische afstotingen minimaliseert van de vier atomen die zijn gekoppeld aan.
Op deze manier is Cho's molecuul4 Het kan worden weergegeven als een tetraëder (tetraëdrische moleculaire geometrie).
Als, in plaats van H, de C banden zou vormen met andere groepen atomen, wat zou de hybridisatie ervan zijn dan zijn? Op voorwaarde dat koolstof vier links vormt σ (C-A), zal de hybridisatie van het SP zijn3.
Men kan consequent worden aangenomen dat in andere organische verbindingen zoals CH3Oh, CCL4, C (Ch3))4, C6H12 (Cyclohexan), enz., Koolstof heeft een SP -hybridisatie3.
Dit is essentieel om organische structuren te schetsen, waar koolstofatomen met eenvoudige links divergentiepunten vertegenwoordigen; dat wil zeggen, de structuur blijft niet in een enkel vlak.
Interpretatie
Wat is de eenvoudigste interpretatie voor deze hybride orbitalen zonder wiskundige aspecten aan te pakken (golffuncties)? De orbitalen sp3 Ze impliceren dat ze zijn ontstaan door vier orbitalen: één S en drie P.
Omdat de combinatie van deze atomaire orbitalen ideaal zou moeten zijn, de vier SP -orbitalen3 resulterend zijn identiek en bezetten verschillende oriëntaties in de ruimte (zoals in de orbitalen PX, PEn En PZ)).
Het bovenstaande is van toepassing op de rest van de mogelijke hybridaties: het aantal gevormde hybride orbitalen is hetzelfde als dat van de atomaire orbitalen die combineren. Bijvoorbeeld Sp Híbridos Orbital3D2 Ze worden gevormd uit zes atomaire orbitalen: één s, drie p en twee d.
Afwijkingen van linkhoeken
Volgens de afstotingstheorie van elektronische paren van de Valencia -laag (RPECV) bezet een paar vrije elektronen meer volume dan een gekoppeld atoom. Dit zorgt ervoor dat de links weggaan, waardoor de elektronische spanning afneemt en de hoeken van de 109,5º worden afgeleid:
Het kan u van dienst zijn: Cruise for Crucible: Kenmerken, functies, gebruik voorbeelden
In het watermolecuul zijn de atomen van H bijvoorbeeld gekoppeld aan de orbitalen SP3 (in groen), en ook de paren van elektronen die niet worden gedeeld ":" Bezakken deze orbitalen.
De afstotingen van deze elektronenparen worden meestal weergegeven als "twee ballonnen met ogen", die vanwege hun volume de twee links σ o-h afstoten.
Dus in het water zijn de hoeken van verbindingen echt 105º, in plaats van de 109,5º verwacht voor tetraëdrische geometrie.
Welke geometrie heeft hij dan2OF? Heeft een hoekige geometrie. Omdat? Omdat hoewel elektronische geometrie tetraëdrisch is, vervormen twee paar niet gedeelde elektronen het tot een hoekige moleculaire geometrie.
SP2
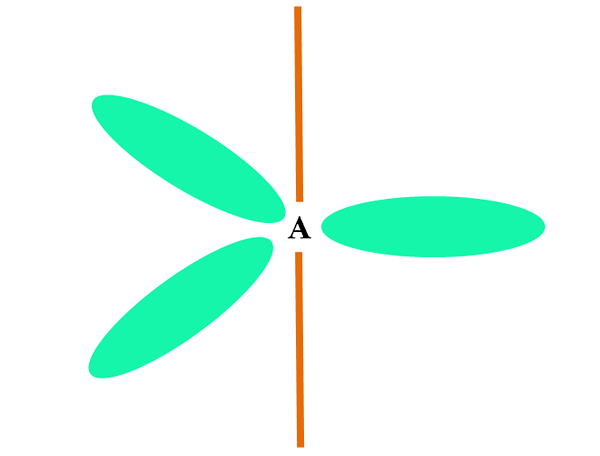
Wanneer een atoom twee of s orbitalen combineert, genereert het drie hybride orbitalen SP2; Een orbitale p (omdat er drie zijn) blijft echter ongewijzigd, die wordt weergegeven als een oranje balk in het bovenste beeld.
Hier, de drie orbitalen sp2 Ze zijn groen om hun verschil te benadrukken met de oranje bar: de orbitale p "pure".
Een atoom met SP -hybridisatie2 Het kan worden gevisualiseerd als een trigonale vlakke vloer (de driehoek getekend met de SP -orbitalen2 groen), met zijn hoekpunten gescheiden door 120º hoeken en loodrecht op een balk.
En welke rol doet het orbitale pure pure spel? Om een dubbele binding te vormen (=). De orbitalen sp2 Ze staan de vorming van drie links σ toe, terwijl de orbitale pure p binding π (een dubbele of drievoudige link omvat een of twee links π).
Bijvoorbeeld om de carbonylgroep en de structuur van het formaldehyde -molecuul te tekenen (h2C = o), het gaat als volgt verder:
Het kan u van dienst zijn: cycopropaan (C3H6)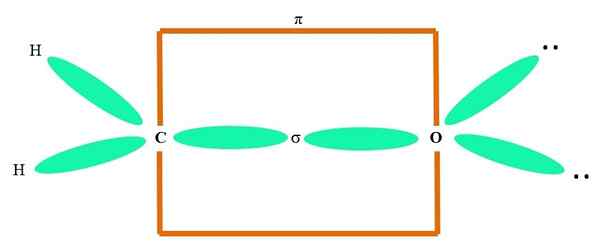
De orbitalen sp2 Zowel de C als van de O vormen een link σ, terwijl de zuivere orbitalen een π -binding vormen (de oranje rechthoek).
Het kan worden opgemerkt hoe de rest van de elektronische groepen (H -atomen en de paren van niet gedeelde elektronen) zich in de andere SP -orbitalen bevinden2, gescheiden door 120º.
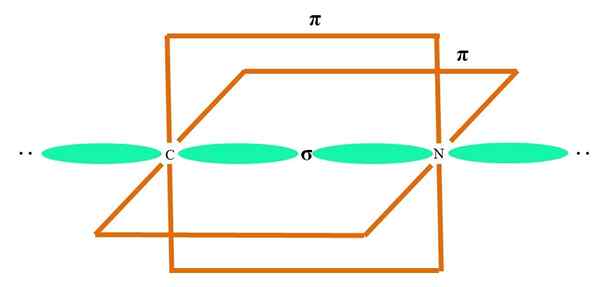
SP
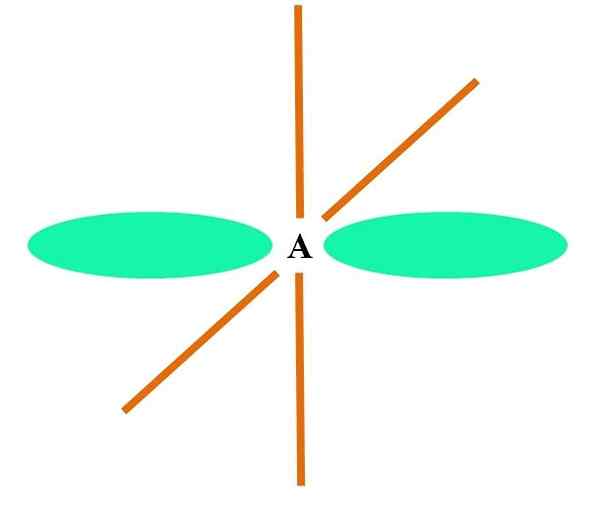
In het superieure beeld wordt een atoom geïllustreerd met SP -hybridisatie. Hier, een orbitale s en een orbitale p. Twee pure orbitale orbitalen zijn nu echter ongewijzigd, waardoor ze twee dubbele links of een drievoudige link (≡) kunnen vormen.
Met andere woorden: als in een structuur A C voldoet aan het bovenstaande (= C = O C≡C), dan is de hybridisatie ervan SP. Voor andere minder illustratieve atomen - zoals overgangsmetalen - is de beschrijving van elektronische en moleculaire geometrieën ingewikkeld omdat de orbitalen D en zelfs de F ook worden overwogen.
Hybride orbitalen worden gescheiden onder een hoek van 180º. Om deze reden zijn de gekoppelde atomen gerangschikt in een lineaire moleculaire geometrie (B-A-B). Ten slotte is in het lagere beeld de cyanide -anionstructuur te zien: