Helio -geschiedenis, eigenschappen, structuur, risico's, gebruik

- 1897
- 518
- Cecil Graham
Hij helium Het is een chemisch element waarvan het symbool is. Dit is het eerste edelgas in het periodiek systeem en bevindt zich meestal aan het einde van hetzelfde. Onder normale omstandigheden is het een inerte gas, omdat geen van de weinige verbindingen stabiel is; Het breidt ook zeer snel uit en is de stof met het minste kookpunt van allemaal.
Op het populaire niveau is het een goed bekend gas, omdat het in ontelbare gebeurtenissen of kinderfeesten gebruikelijk is. Wat echt en voor altijd is verloren voor de hoeken van het zonnestelsel, en daarna zijn het de heliumatomen die worden vrijgegeven zodra de wereld is afgebroken.
 Ballonnen opgeblazen met helium, het dichtst in de buurt van dit element in alledaagse situaties. Bron: Pixabay.
Ballonnen opgeblazen met helium, het dichtst in de buurt van dit element in alledaagse situaties. Bron: Pixabay. In feite zijn er mensen die, en met grote reden, geloven dat heliumballonnen een ongepaste praktijk voor dit gas vertegenwoordigen. Gelukkig heeft het belangrijker en interessant gebruik, dankzij de fysische en chemische eigenschappen die het scheiden van andere chemische elementen.
Vloeibaar helium is bijvoorbeeld zo koud dat het alles kan bevriezen, als een metalen legering, waardoor het een supergeleider -materiaal is. Het is ook een vloeistof die superfluiditeit manifesteert, in staat om de wanden van een glazen container te beklimmen.
Zijn naam is omdat hij voor het eerst werd geïdentificeerd in de zon en niet op aarde. Het is het tweede meest voorkomende element in het hele universum en, hoewel de concentratie ervan belachelijk is in de korst van de aarde, kan het worden verkregen uit de reserves van aardgas en radioactieve mineralen van uranium en thorium.
Hier toont het helium weer een merkwaardig feit: het is een gas dat veel meer in overvloed in de ondergrond is dan in de atmosfeer, waar het uit de aarde en het zwaartekrachtveld ontsnapt.
[TOC]
Geschiedenis
Het helium werd niet op aarde ontdekt, maar in de zon. In feite komt zijn naam van het Griekse woord 'helios', wat zon betekent. Het bestaan van het element alleen contrasteerde het periodiek systeem van Dmitri Mendeléyev, omdat er geen plaats was voor een nieuw gas; dat wil zeggen, tegen die tijd was er absoluut niets over edelgassen.
De naam 'Helio', geschreven als 'helium' in het Engels, eindigde met het achtervoegsel -ium dat het als metaal verwijst; Juist omdat het bestaan van een ander gas afgezien van zuurstof, waterstof, fluor, chloor en stikstof niet kon worden opgenomen.
Deze naam werd aangewezen door de Engelse astronoom Norman Lockyer, die vanuit Engeland bestudeerde wat werd waargenomen door de Franse astronom.
Het was tot dan toe een gele spectrale lijn van een onbekend element. Lockyer zei dat dit te wijten was aan de aanwezigheid van een nieuw chemisch element in de zon.
In 1895, bijna twintig jaar later, herkende de Schotse chemicus Sir William Ramsay hetzelfde spectrum van een resterend gas bij het bestuderen van een radioactief mineraal: Cleveíta. Er was hier daarom ook Helio.
Fysische en chemische eigenschappen
Verschijning
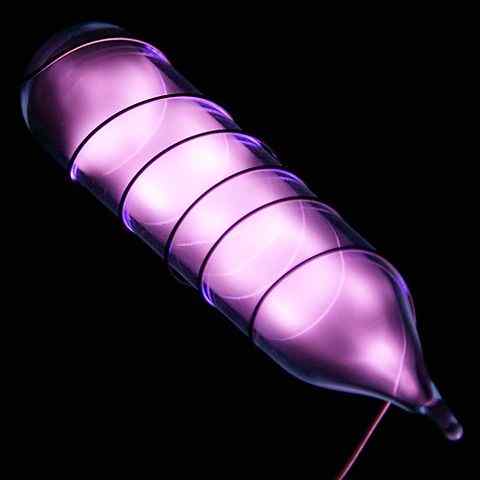 Ampoule met een heliummonster die schijnt na een elektrische schok. Bron: Hi-Res afbeeldingen van chemische elementen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Ampoule met een heliummonster die schijnt na een elektrische schok. Bron: Hi-Res afbeeldingen van chemische elementen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Helium is een kleurloos, geurloos gas, dat geen smaak heeft en ook inert is. Wanneer echter een elektrische schok wordt aangebracht en afhankelijk van het spanningsverschil, begint deze te schijnen als een grijsachtige morte (bovenste afbeelding), om vervolgens te schijnen met een oranje gloed. Daarom zijn heliumlichten oranje.
Atoomnummer (z)
2
Molaire massa
4,002 g/mol
Smeltpunt
-272.2 ºC
Kookpunt
-268,92 ºC
Dikte
-0,1786 g/l, onder normale omstandigheden, dat wil zeggen in een gasfase.
-0,145 g/ml, op het smeltpunt, het vloeibare helium.
-0,125 g/ml, net wanneer het helium begint te koken.
-0,187 g/ml, bij 0 K en 25 atm, dat wil zeggen solide helium voor die specifieke druk- en temperatuuromstandigheden.
Drievoudige punt
2.177 K en 5.043 kPa (0,04935 atm)
Kritisch punt
5.1953 K en 0.22746 MPA (2.2448 ATM)
Fusiewarmte
0,0138 kJ/mol
Verdampingswarmte
0,0829 kJ/mol
Molaire warmtecapaciteit
20.78 J/(mol · k)
Dampdruk
0.9869 ATM bij 4,21 K. Deze waarde dient om een idee te geven van hoe vloot.
Ionisatie -energieën
-Eerst: 2372.3 kJ/mol (hij+ gasvormig)
-Ten tweede: 5250,5 kJ/mol (hij2+ gasvormig)
Ionisatie -energieën voor helium zijn bijzonder hoog omdat het gasatoom een elektron moet verliezen, dat een sterke effectieve nucleaire belasting ervaart. Het kan ook worden begrepen als de kleine omvang van het atoom wordt overwogen en hoe "dichtbij" de twee elektronen zijn met betrekking tot de kern (met hun twee protonen en twee neutronen).
Oplosbaarheid
In het water wordt 0,97 ml opgelost per 100 ml water bij 0 ºC, wat betekent dat het weinig oplosbaar is.
Kan u van dienst zijn: ammoniumoxalaatReactiviteit
Helium is het tweede minst reactieve chemische element in de natuur. In normale omstandigheden is het succesvol om te bevestigen dat het een inert gas is; Nooit (voor wat het lijkt) kan een heliumverbinding in een kamer of laboratorium worden gemanipuleerd zonder grote druk die erop handelt; Of misschien, dramatisch hoge of lage temperaturen.
Een voorbeeld dat we zien in de NA -verbinding2Hij, die alleen stabiel is onder een druk van 300 GPa, gereproduceerd in een diamant yunque cel.
Terwijl de chemische bindingen in de NA2Hebben "vreemden" omdat ze hun elektronen goed in de kristallen hebben, ze zijn verre van eenvoudige interacties van van der wanden en daarom bestaat het niet alleen uit heliumatomen die zijn gevangen door moleculaire aggregaten. Dit is waar het dilemma tussen welke heliumverbindingen echt zijn en welke niet.
Stikstofmoleculen in hoge druk kunnen bijvoorbeeld een heliumatoom opsluiten om een soort gekletter te veroorzaken2))elf.
Ook zijn er endo -subverterende complexen van fullereen kationen, c60+N en C70+N, In wiens holtes kunnen ze heliumatomen huisvesten; en het moleculaire kation heh+ (He-h+), gevonden in zeer verre nevels.
Oxidatienummer
Die uit nieuwsgierigheid probeert het oxidatienummer voor helium in een van de verbindingen te berekenen, zal vaststellen dat dit gelijk is aan 0. In de NA2Hij zou bijvoorbeeld kunnen worden gedacht dat zijn formule overeenkomt met hypothetische naionen2+Hij2-; Maar dat zou zijn om aan te nemen dat hij een puur ionisch karakter heeft, terwijl in werkelijkheid zijn banden verre van zijn.
Bovendien wint helium geen elektronen omdat het hen niet kan accommoderen in de 2s orbitale, niet -beschikbare energie; En het is ook niet mogelijk dat u ze verliest, vanwege de verminderde grootte van het atoom en de grote effectieve nucleaire belasting van zijn kern. Dat is de reden waarom Helium altijd (in theorie) deelneemt als een atoom0 In zijn afgeleide verbindingen.
Elektronische structuur en configuratie
Het helium bezet, net als alle gassen die zijn waargenomen in een macroescala, het volume van de containers die het opslaat, waardoor het een onbepaalde manier heeft. Wanneer de temperatuur echter daalt en onder -269 ºC begint te koelen, condenseert het gas in een kleurloze vloeistof; De helium I, de eerste van de twee vloeibare fasen voor dit element.
De reden waarom het helium condenseert op zo'n lage temperatuur is te wijten aan de weinige dispersiekrachten die hun atomen bij elkaar houden; Wat de fase ook beschouwt. Dit kan worden uitgelegd vanuit de elektronische configuratie:
1s2
Waarin twee elektronen het 1s atomaire orbitaal bezetten. Helium -atoom kan worden gevisualiseerd als een bijna perfecte bol, waarvan de homogene elektronische periferie niet erg vatbaar is voor polariseren door de effectieve nucleaire belasting van de twee protonen in de kern.
Spontane en geïnduceerde dipoolmomenten zijn dus ongewoon en zeer zwak; Dus de temperatuur moet de absolute nul naderen, zodat de atomen voldoende traagheid hebben benaderd en hun dispersieve krachten een vloeistof hebben laten definiëren; Of nog beter, een heliumglas.
Dimmen
In de gasvormige fase heeft de ruimte die de atomen scheidt zodanig dat kan worden aangenomen dat een van de anderen altijd gescheiden is. Zozeer zelfs dat in een blaar van weinig volume het helium er kleurloos uitziet totdat het wordt onderworpen aan een elektrische schok, die zijn atomen ioniseert in een grijsachtige en weinig heldere mist.
In de vloeibare fase kunnen de atomen echter, zelfs met hun zwakke interacties, niet langer "negeren". Nu staat de dispersiekracht hen toe2. Daarom kun je helium I beschouwen als enorme clusters van hij2 in balans met zijn stoomfase -atomen.
Daarom is helium I zo moeilijk te onderscheiden van de dampen. Als deze vloeistof buiten zijn hermetische container wordt gemorst, ontsnapt deze als een witachtige flare.
Helio II
Wanneer de temperatuur nog meer daalt en de 2.178 K (-270.972 ºC) aanraakt, treedt een fase-overgang op: helium I wordt omgezet in helium II.
Vanaf dit punt wordt de fascinerende heliumvloeistof een overbodige of kwantumvloeistof; dat wil zeggen, de macroscopische eigenschappen worden gemanifesteerd alsof de dimeren2 Het waren individuele atomen (en misschien zijn ze dat). Het mist volledige viscositeit, omdat er geen oppervlak is dat een atoom kan stoppen tijdens het glijden of "klimmen".
Dat is de reden waarom Helio II kan stijgen door de wanden van een glazen container die de zwaartekracht overwint; Ongeacht hoe hoog ze zijn, zolang het oppervlak op dezelfde temperatuur blijft en daarom niet volat kan worden.
Het kan u van dienst zijn: hypofysezuur (H3PO2): eigenschappen, gebruik en reagentiaHierdoor kan het vloeibare helium niet in glazen containers worden bewaard, omdat het zou ontsnappen vóór de geringste spleet of maas in de wet; Erg vergelijkbaar met hoe zou het gebeuren met een gas. In plaats daarvan wordt roestvrij staal gebruikt om deze containers te ontwerpen (Dewars -tanks).
Kristallen
Hoewel de temperatuur daalde tot 0 K (de absolute nul), zou de dispersiekracht tussen de atomen niet sterk genoeg zijn om ze in een kristallijne structuur te bestellen. Om stolling te maken, moet de druk toenemen tot ongeveer 25 atm; En dan verschijnen compacte zeshoekige kristallen (HCP).
Geofysische studies tonen aan dat deze HCP -structuur verreweg ongewijzigd blijft dat de druk wordt verhoogd (tot de orde van de Pascal Giga, GPA). Er is echter een smal gebied in zijn druk-temperatuurdiagram waarbij deze HCP-kristallen een overgang lijden naar een kubieke fase gecentreerd op het lichaam (BCC).
Waar is het en verkrijgt
Cosmos en rotsen
 Het helium vertegenwoordigt het tweede meest voorkomende element van het universum en 24% van zijn massa. Bron: Pxhere.
Het helium vertegenwoordigt het tweede meest voorkomende element van het universum en 24% van zijn massa. Bron: Pxhere. Helium is het tweede meest voorkomende element in het hele universum, alleen overtroffen door waterstof. De sterren produceren constant onmetelijke hoeveelheden heliumatomen door twee waterstofkernen te fuseren tijdens het nucleosyntheseproces.
Evenzo is elk radioactief proces dat α -deeltjes uitzendt een productiebron van heliumatomen als ze interageren met de elektronen van de omgeving; Bijvoorbeeld, met die van een rotslichaam in tanks met radioactieve mineralen van uranium en thorium. Deze twee elementen lijden op radioactief verval, beginnend met uranium:
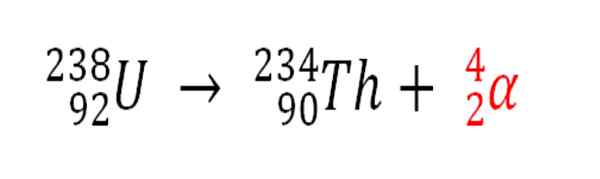 Radioactief verval in uranium bij de vorming van Alfas -deeltjes, die vervolgens transformeren in heliumatoom in ondergrondse afzettingen. Bron: Gabriel Bolívar.
Radioactief verval in uranium bij de vorming van Alfas -deeltjes, die vervolgens transformeren in heliumatoom in ondergrondse afzettingen. Bron: Gabriel Bolívar. Daarom zullen in de rotsen waar deze radioactieve mineralen geconcentreerd zijn, heliumatomen worden gevangen, die worden vrijgegeven zodra ze worden verteerd in zure media.
Onder sommige van deze mineralen zijn Cleveíta, Carnotita en Uraninite, allemaal samengesteld uit uraniumoxiden (UO2 of u3OF8) en onzuiverheden van thorium, zware metalen en zeldzame aardes. Het helium, geïrrigeerd door ondergrondse kanalen, kan uiteindelijk ophopen in aardgasreservoirs, minerale bronnen of in meteorische ijzers.
Naar schatting wordt een heliummassa gelijkwaardig aan 3000 ton geproduceerd, van het radioactieve verval van uranium en thorium.
Lucht en zeeën
Het helium is niet erg oplosbaar in het water, dus eerder in plaats van later stijgt het uit de diepten (waar de oorsprong wordt gevonden), om de lagen van de atmosfeer over te steken en uiteindelijk de Sidereal -ruimte te bereiken. De atomen zijn zo klein en licht dat het zwaartekrachtveld van de aarde ze niet in de atmosfeer kan behouden.
Vanwege het bovenstaande is de concentratie van helium zowel in de lucht (5,2 ppm) als in de zeeën (4 ppt) erg laag.
Als u uit een van die twee media zou willen extraheren, zou de "beste" optie de lucht zijn, die deze eerst zou moeten indienen bij vloeibaar om al zijn componentgassen te condenseren, terwijl het helium in een gasvormige toestand blijft.
Het is echter niet praktisch om helium uit de lucht te verkrijgen, maar van de rotsen verrijkt met radioactieve mineralen; Of nog beter, van aardgasreserves, waar helium tot 7% van de totale massa kan vertegenwoordigen.
Aardgas liquefactie en destillatie
In plaats van de lucht te onderwerpen, is het eenvoudiger en winstgevender. Aldus is de grondstofpartnagement (commercieel) om helium te verkrijgen aardgas, die ook kan worden onderworpen aan fractionele destillatie.
Het eindproduct van destillatie is klaar met zuivering met geactiveerde koolstof, die door een grote zuiverheid helium gaat. En ten slotte scheidt helium van neon door een cryogeen proces waarbij vloeibaar helium wordt gebruikt.
Isotopen
Helium wordt voornamelijk in de natuur gepresenteerd als de isotoop 4Hij, wiens naakte kern het beroemde deeltjes α is. Dit atoom van 4Ik heb twee neutronen en twee protonen. In mindere overvloed is de isotoop 3Hij, die maar één neutron heeft. De eerste is zwaarder (het heeft een grotere atoommassa) dan de tweede.
Dus het isotooppaar 3Hij en 4Hebben zijn degenen die de mesibele eigenschappen definiëren en wat we van helium begrijpen als een chemisch element. Sinds de 3Hij is lichter, er wordt aangenomen dat hun atomen meer kinetische energie hebben en dat ze daarom een nog lagere temperatuur nodig hebben om samen te komen in een overbodige.
Hij 3Ik heb hier op aarde een zeer zeldzame soort beschouwd; In maanbodem is het echter overvloediger (ongeveer 2000 keer). Daarom is de maan onderworpen aan projecten en verhalen als een mogelijke bron van 3Hij, die kan worden gebruikt als een nucleaire brandstof voor het ruimtevaartuig van de toekomst.
Kan u van dienst zijn: pure stoffenOnder andere kunnen heliumisotopen worden genoemd, met hun respectieve halfwaardetijden: 5HIJ (T1/2= 7,6 · 10−22 S), 6HIJ (T1/2= 0,8 s) en 8HIJ (T1/2= 0,119 s).
Risico's
Helium is een inert gas en neemt daarom niet deel aan een van de reacties die zich in ons lichaam voordoen.
De atomen komen praktisch binnen en worden uitgeademd zonder hun interacties met biomoleculen die een daaropvolgend effect produceren; behalve in het geluid dat wordt uitgestoten door de stembanden, die acuter worden en meer frequentie hebben.
Mensen die Helio van een ballon inhaleren (met mate), spreken met een acute stem, vergelijkbaar met die van een eekhoorn (of eend).
Het probleem ligt in het feit dat als die persoon een ongepast aantal helium inhaleert, het risico op verstikkende runs, omdat hun atomen naar zuurstofmoleculen gaan; En daarom zal het niet kunnen ademen totdat al dat helium uitademt, wat op zijn beurt vanwege de druk het longweefsel kan scheuren of barotrauma's kan veroorzaken.
Gevallen van mensen die zijn overleden aan het inademen van Helio zijn gemeld vanwege de nieuw uitgelegd.
Aan de andere kant, hoewel het geen brandrisico vertegenwoordigt, gezien het gebrek aan reactiviteit op zuurstof (of andere substantie), als het wordt opgeslagen onder hoge drukken en ontsnapt, kan de ontsnapping fysiek gevaarlijk zijn.
Toepassingen
Helio's fysische en chemische eigenschappen maken het niet alleen een speciaal gas, maar ook een zeer nuttige stof voor toepassingen die temperaturen verdienen in extreem laag. In deze sectie worden sommige van deze toepassingen of toepassingen aangepakt.
Druk- en zuiveringssystemen
In sommige systemen is het noodzakelijk om de druk te verhogen (druk), en hiervoor moet het worden geïnjecteerd of levering die geen interactie heeft met een van zijn componenten; Bijvoorbeeld met reagentia of oppervlakken die gevoelig zijn voor ongewenste reacties.
Aldus kan de druk worden verhoogd met heliumvolumes, waarvan de chemische traagheid het ideaal maakt voor dit doel. De inerte atmosfeer die vergemakkelijkt is groter dan bepaalde gevallen van stikstof.
Voor het omgekeerde proces, dat wil zeggen purge, wordt helium ook gebruikt vanwege het vermogen om alle zuurstof, waterdampen of ander gas te slepen, waarvan de aanwezigheid wil elimineren. Op deze manier wordt de systeemdruk verlaagd zodra het helium is geleegd.
Lekdetecties
Het helium kan door de geringste spleet worden gefilterd, dus het dient ook om lekken in pijpen, hoog -vacuümcontainers of cryogene tanks te detecteren.
Soms kan detectie visueel of door aanraking worden gedaan; Meestal is een detector echter wat het signaal "gooit" van waar en hoeveel helium ontsnapt aan het systeem onder inspectie.
Sleepgas
Heliumatomen, zoals vermeld voor purge -systemen, kunnen het slepen, afhankelijk van uw druk, zwaardere moleculen. Dit principe wordt bijvoorbeeld dagelijks gebruikt in gaschromatografie -analyse, omdat het het monster kan slepen dat langs de kolom is versterkt, waar het interageert met de stationaire fase.
Ballonnen en luchtschepen
 Helium wordt gebruikt om de luchtschepen op te blazen en is veel veiliger dan waterstof omdat het geen brandbaar gas is. Bron: Pixabay.
Helium wordt gebruikt om de luchtschepen op te blazen en is veel veiliger dan waterstof omdat het geen brandbaar gas is. Bron: Pixabay. Vanwege de lage dichtheid in vergelijking met lucht en, nogmaals, het gebrek aan reactiviteit met zuurstof, is het gebruikt om ballonnen op kinderpartijen op te blazen (gemengd met zuurstof zodat niemand verstikt is voor ademhaling), en luchtschepen (superieur beeld) , zonder een risico op vuur te kunnen vertegenwoordigen.
Duiken
 Het helium is een van de belangrijkste componenten van de zuurstoftanks waarmee de duikers ademen. Bron: Pxhere.
Het helium is een van de belangrijkste componenten van de zuurstoftanks waarmee de duikers ademen. Bron: Pxhere. Wanneer de duikers naar grotere diepten afdalen, vinden ze het moeilijk om te ademen als gevolg van de grote druk die door het water wordt uitgeoefend. Dat is de reden waarom Helio wordt toegevoegd in zijn zuurstoftanks om de dichtheid van het gas te verminderen dat de duikers ademen en uitademen, en dus kan het worden uitgeademd met minder werk.
Booglassen
In het lasproces brengt de elektrische boog voldoende warmte zodat de twee metalen worden samengevoegd. Indien uitgevoerd onder een atmosfeer van helium, zal het gloeilampen niet reageren met de zuurstof van de lucht om het respectieve oxide te worden; Daarom voorkomt helium dat dit gebeurt.
Supergeleiders
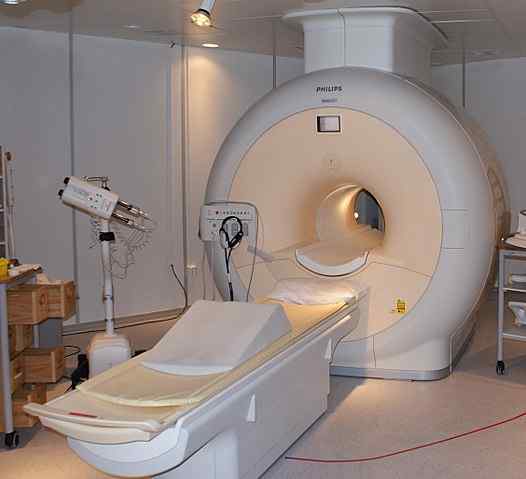 Vloeibaar helium wordt gebruikt om de magneten te koelen die worden gebruikt in de scanners van nucleaire magnetische resonantie beeldvorming. Bron: Jan Ainali [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Vloeibaar helium wordt gebruikt om de magneten te koelen die worden gebruikt in de scanners van nucleaire magnetische resonantie beeldvorming. Bron: Jan Ainali [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Vloeibaar helium is zo koud dat het metalen kan bevriezen om ze in supergeleiders te transformeren. Dankzij dit zijn zeer krachtige magneten vervaardigd, die, gekoeld met vloeibaar helium, zijn gebruikt in afbeeldingen van afbeeldingen of spectrometers van nucleaire magnetische resonantie.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Andy Estance. (17 april 2019). Heliumhydride -ion voor het eerst gedetecteerd in de ruimte: bewijsmateriaal gevonden voor ongrijpbare chemie uit de eerste minuten van het universum. Hersteld van: chemieworld.com
- Peter Wothers. (19 augustus 2009). Helium. Chemie in zijn element. Hersteld van: chemieworld.com
- Wikipedia. (2019). Helium. Opgehaald uit: in.Wikipedia.borg
- Mao, h. K., Wu, en., Jephcoat, a. P., Hemley, r. J., Bell, p. M., & Bassett, W. NAAR. (1988). Kristalstructuur en dichtheid van helium tot 232 kbar. Opgehaald uit: artikelen.Advertenties.Harvard.Edu
- Nationaal centrum voor biotechnologie -informatie. (2019). Helium. PubChem -database. CID = 23987. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Mary-Ann Muffoletto. (6 februari 2017). Omhoog, omhoog en weg: chemici zeggen 'ja', helium kan verbindingen vormen. Utah State University. Hersteld van: Phys.borg
- Steve Gagnon. (S.F.)). Isotopen van het element helium. Jefferson Lab. Hersteld van: onderwijs.Jlab.borg
- Advameg, Inc. (2019). Helium. Hersteld van: chemiexplaed.com

