Globin -kenmerken, structuur, functie en veranderingen
- 4419
- 49
- Aaron Okuneva
De globine Het is een structuur van eiwit natuur gerangschikt in bolvormige of bolvormige vorm, zijnde waar de naam vandaan komt. Deze structuur is van het tertiair type en wordt gekenmerkt door complex te zijn, omdat de aminozuurketen vouwt om sferoproteïne te vormen. Er zijn verschillende soorten globin -ketens en deze zijn geclassificeerd in Griekse letters: Alfa, Beta, Delta, Gamma, Epsilon en Zeta.
De aminozuren die de primaire structuur van het eiwit vormen, variëren volgens de soort waartoe ze behoren (mensen of dieren). Er zijn ook variaties binnen dezelfde soort volgens de huidige staat van leven van het organisme (embryonisch leven, foetale leven of geboorte na de geboorte).
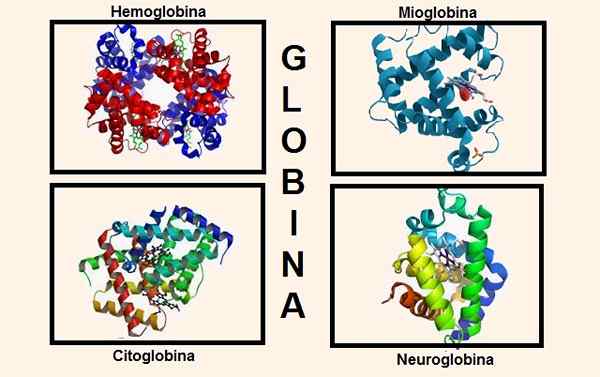
 Verschillende structuren die globine bevatten in zijn compositie. Bronnen: Wikipedia.com/Biancadescals [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]/De originele uploader was ProteinBoxBot bij Engelse Wikipedia. [Public Domain]/Wikipedia.com
Verschillende structuren die globine bevatten in zijn compositie. Bronnen: Wikipedia.com/Biancadescals [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]/De originele uploader was ProteinBoxBot bij Engelse Wikipedia. [Public Domain]/Wikipedia.com Genetische informatie voor de synthese van de verschillende globineketens is opgenomen in verschillende chromosomen. Alpha -ketenglobines worden bijvoorbeeld gevonden op chromosoom 16, terwijl de genetische informatie van bèta, delta, gamma en epsilon op chromosoom 11 staan.
[TOC]
Kenmerken
Globine maakt deel uit van belangrijke structuren in het lichaam, bijvoorbeeld de meest relevante zijn: hemoglobine en myoglobine.
Hemoglobine bevat vier globineketens (Alfa 1 en Alfa 2) en (Beta 1 en Beta 2). Elke globine heeft een replicatie waar het de Hemo -groep beschermt.
Aan de andere kant is er myoglobine. Die een minder complexe structuur heeft dan hemoglobine. Dit presenteert een single -strip bolypeptide gerangschikt secundair.
Tot voor kort werd aangenomen dat dit de enige stoffen waren die globine bevatten in hogere wezens, maar vandaag zijn er nog twee bekend die globine in hun grondwet hebben: cytoglobine en neuroglobine.
De cytoglobine is aanwezig in de meeste weefsels en bevindt zich vooral in het bindweefsel, evenals het in het netvlies gevonden.
Op zijn beurt heeft neuroglobine de voorkeur voor zenuwweefsel, vandaar zijn naam. Neuroglobine is gevonden in hersenzenuwcellen op het niveau van de hersenschors, evenals op andere locaties zoals de thalamus, de hypothalamus, de hippocampus en de cerebellum.
Kan u van dienst zijn: Linneaanse taxonomie van levende wezensZe zijn echter niet de enige locaties, omdat het buiten het zenuwstelsel kan worden gevonden in eilandjes van Langerhans van de alvleesklier en in het netvlies.
Structuur
Er zijn 6 verschillende soorten globineketens die worden aangeduid met de letters van het Griekse alfabet: alfa (α), bèta (β), gamma (γ), delta (Δ), epsilon (ε) en zeta (ζ). Deze ketens behoren tot de familie van globinas, maar verschillen van elkaar in het aantal aminozuren dat ze bezitten.
Deze polypeptiden hebben een primaire, secundaire en tertiaire structuur. De eenvoudige aminozuurketen vertegenwoordigt de primaire structuur. Wanneer de ketting wordt gerold door het vormen van spiralen of propellers vormen de secundaire structuur.
Als deze structuur vervolgens vele malen op zichzelf vouwt, vormt het een bolvormige structuur die overeenkomt met de tertiaire structuur.
Evenzo kunnen ze alleen de quaternaire vorm verwerven wanneer 4 moleculen of globineketens worden gecombineerd in een tertiaire vorm.
Dit wordt gepresenteerd in de complexe structuur van hemoglobine. In myoglobine is het echter anders. In dit geval wordt globine gepresenteerd als een monomeer, dat wil zeggen dat het een enkele peptideketen heeft die in vouwen is gerangschikt, waardoor 8 propellers ontstaan (secundaire structuur).
Zowel hemoglobine als myoglobine huis een hemo -groep in hun complexe structuur.
Hemoglobine
In dit molecuul zijn 2 alfabolineketens en 2 bètaketens verbonden. Dit is hoe ze perfect gekoppeld zijn om de Hemo -groep in het midden te huisvesten, plus ijzer.
Onder deze structuren zijn er zwakke vakbonden en sterke vakbonden. In de zwakke vakbonden nemen 19 aminozuren deel en de vakbond treedt als volgt op: de Alfa 1 -keten sluit zich aan bij de Beta 2 -keten en de Alfa 2 -ketting sluit zich aan bij de bètaceten 1.
Terwijl 35 aminozuren en de ketens die zich aansluiten zijn: Alfa 1 -keten sluit zich aan bij de Beta 1 -keten en de Alfa 2 -ketting sluit zich aan bij de Beta 2 Chain 2.
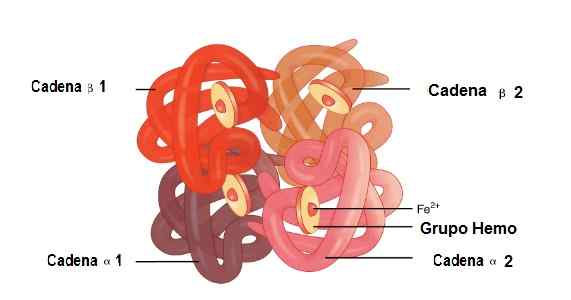 Locatie van de Alfa 1 en Alfa 2, Beta 1 en Beta 2 -ketens in de hemoglobinestructuur. Bron: OpenX College [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] bewerkte afbeelding (vertaald in het Spaans)
Locatie van de Alfa 1 en Alfa 2, Beta 1 en Beta 2 -ketens in de hemoglobinestructuur. Bron: OpenX College [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] bewerkte afbeelding (vertaald in het Spaans) Myoglobine
In myoglobine is er ook een bolvormige eiwitgroep aanwezig, maar in dit geval is er een enkele peptideketen bestaande uit 153 aminozuren. De ruimtelijke instelling is secundair en presenteert 8 alfa propellers.
Het kan je van dienst zijn: oligoements: waar zijn ze, waar zijn ze voor en waar zijn zeDeze eiwitstructuur plaatst strategisch hydrofobe aminozuren in de structuur, terwijl hydrofiele of polaire aminozuren naar buiten worden gevonden.
Dit ontwerp is perfect om de Hemo -groep binnen te huisvesten (hydrofobe deel). Dit bindt aan eiwitten door niet -covalente bindingen.
Cytoglobine
Het werd ontdekt in 2001 en er wordt gezegd dat het een soort hemoglobine is, maar het verschilt in die zin dat het hexacoordinateerd is, terwijl hemoglobine en myoglobine pentacoordineerd zijn. Dit heeft te maken met de positie die wordt aangenomen door het histidine -aminozuur dicht bij de Hemo -groep.
Neuroglobine
Zijn ontdekking werd gedaan in 2000. Neuroglobine is een monomeer met 150 aminozuren, daarom lijkt het erg op myoglobine. De structuur van neuroglobine heeft een overeenkomst tussen 21 en 25% met myoglobine en hemoglobine.
Functie
Omdat globine niet alleen in het lichaam is, maar deel uitmaken van bepaalde structuren, worden de functies die elk van hen vervullen genoemd:
Hemoglobine
Het bevindt zich in de erytrocyten. Het is verantwoordelijk voor het repareren en transport van zuurstof van de longen naar de weefsels. Evenals het lichaam van koolstofdioxide, het maken van de tegenovergestelde route.
Myoglobine
De Hemo -groep in globine heeft de functie van het opslaan van zuurstofmoleculen om de hartspier en skeletspier te zuurstofmachines oxygeneren.
Cytoglobine
Aangenomen wordt dat dit eiwit de bescherming van hypoxie en oxidatieve stressstaten in weefsels beïnvloedt. Er wordt ook gedacht dat arteriële zuurstof naar de hersenen kan transporteren.
Neuroglobine
Er wordt gedacht dat neuroglobine het vermogen heeft om zuurstof, monoxide te repareren koolstof- en stikstofmonoxide.
Het is echter nog niet met zekerheid bekend wat de functie is van neuroglobine, maar er wordt aangenomen dat het verband houdt met de regulatie van hypoxie en cerebrale ischemie. Vooral zou fungeren als een neuroprotector.
Kan u van dienst zijn: Lamarck Transformism TheoryOmdat neuroglobine een structuur heeft die vergelijkbaar is met hemoglobine en myoglobine, wordt gespeculeerd dat het op neuronaal niveau kan deelnemen aan de toevoer van zuurstof. Er wordt ook aangenomen dat het vrije radicalen en stikstof kan elimineren die zich in de ademhalingsketen voordoen.
In relatie tot stikstofoxide wordt gedacht dat het het elimineert wanneer zuurstof normaal is en het in hypoxie -processen van niet produceert2.
Wijzigingen
Alpha- en bètacetens van globine worden gecodeerd door verschillende genen die zich respectievelijk op chromosomen 16 en 11 bevinden.
Individuen met hemoglobine S (falciform of drapanocytische anemie) hebben een defect in de bètaceten van globine. Het defect bestaat uit een vervanging van stikstofbases op het niveau van nucleotide -nummer 20 van het betrokken gen, waar een adenineverandering is door een tijd.
Mutaties in het β -genS van chromosoom 11 ontstaat verschillende halopes van globinas genaamd: Senegal, Kameroen, Benín, Bantú of CAR en Aziatisch of Arabisch-Indiaans.
Het kennen van het type haplotype gepresenteerd door patiënten met falciforme anemie is belangrijk epidemiologisch, omdat het het mogelijk maakt om de verdeling van verschillende haplotypes te kennen, maar ook deze informatie biedt belangrijke gegevens om de prognose van de ziekte te kennen.
Bijvoorbeeld: het is bekend dat het Bantu -halotype ernstiger is, terwijl het Senegal- en Aziatische type milder zijn.
De verschillen tussen een haplotype en een andere leugen in de hoeveelheid hemoglobine F die ze bezitten. Een hoger percentage hemoglobine F en lagere hemoglobine's betere prognose. Minder hemoglobine F en meer hemoglobine's slechtere prognose.
Deze mutaties worden autosomisch geërfd samen met de mutatie van de hemoglobine.
Referenties
- "Globin." Wikipedia, gratis encyclopedie. 19 oktober 2018, 13:44 UTC. 11 juli 2019, 17:26, Wikipedia.borg
- "Myoglobine." Wikipedia, gratis encyclopedie. 7 juli 2019, 21:16 UTC. 11 juli 2019, 20:42, Wikipedia.borg
- Durán C, Morales O, Echeverri S, Isaza M. Beta -globine -genhalotypes in hemoglobineverdragers in Colombia. Biomedical 2012; 32: 103-111. Beschikbaar bij: Scielo.borg
- Forrellat M, Hernández P. Neuroglobin: nieuw lid van de Globinas -familie. Cubaanse rev immunol hemother 2011; 27 (3): 291-296. Beschikbaar bij: Scielo.Sled
- "Cytoglobine." Wikipedia, gratis encyclopedie. 1 september 2017, 17:26 UTC. 12 juli 2019, 00:28 Wikipedia.borg
- « Heteropolysaccharidenkenmerken, structuur, functies
- Paranoïde schizofrenie symptomen, oorzaken en behandelingen »

