Moleculaire geometrieconcept, typen en voorbeelden
- 1698
- 453
- Irving McClure I
De Moleculaire geometrie of moleculaire structuur Het is de ruimtelijke verdeling van atomen rond een centraal atoom. Atomen vertegenwoordigen gebieden waar een hoge elektronische dichtheid is en daarom worden beschouwd als elektronische groepen, ongeacht de links die zich vormen (eenvoudig, dubbel of drievoudig).
De moleculaire geometrie van een element kan enkele van zijn fysische of chemische eigenschappen karakteriseren (kookpunt, viscositeit, dichtheid, enz.)). De moleculaire structuur van water bepaalt bijvoorbeeld de oplosbaarheid ervan.
 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Dit concept is geboren uit de combinatie en experimentele gegevens van twee theorieën: die van de Valencia Link (TEV) en de afstoting van de elektronische paren van de Valencia Layer (RPECV). Terwijl de eerste de links en hun hoeken definieert, vestigt de tweede geometrie en bijgevolg de moleculaire structuur.
Welke geometrische vormen kunnen moleculen aannemen? De twee eerdere theorieën dragen de antwoorden bij. Volgens de RPECV moeten de atomen en paren van vrije elektronen op een zodanige manier in de ruimte worden gerangschikt dat de elektrostatische afstoting tussen hen afneemt tot het maximum.
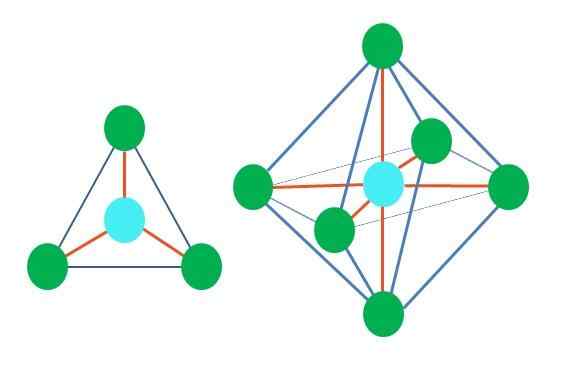
Geometrische vormen zijn dus niet willekeurig, maar zoek het meest stabiele ontwerp. In de bovenste afbeelding is bijvoorbeeld een driehoek aan de linkerkant te zien en rechts een octaëder. Groene punten vertegenwoordigen de atomen en oranje strepen de links.
In de driehoek zijn de drie groene punten georiënteerd in een scheiding van 120º. Met deze hoek, die gelijk is aan die van de link, kunnen atomen elkaar afstoten. Daarom zal een molecuul met een centraal atoom bevestigd aan drie anderen een platte trigonale geometrie aannemen.
De RPECV voorspelt echter dat een paar vrije elektronen in het centrale atoom de geometrie zullen vervormen. In het geval van het trigonale vlak duwt dit koppel de drie groene punten naar beneden, wat resulteert in een trigonale piramide -geometrie.
Hetzelfde kan ook gebeuren met de octaëder van de afbeelding. In dit alles worden atomen op de meest stabiele manier gescheiden.
[TOC]
Hoe u van tevoren de moleculaire geometrie van een atoom x weet?
Hiervoor is het ook noodzakelijk om vrije elektronen als elektronische groepen te beschouwen. Deze zullen samen met de atomen definiëren wat bekend staat als de Elektronische geometrie, die een onafscheidelijke metgezel van moleculaire geometrie is.
Van elektronische geometrie, en na de paren van vrije elektronen door Lewis -structuur te hebben gedetecteerd, kan worden vastgesteld welke moleculaire geometrie zal zijn. De som van alle moleculaire geometrieën zal een schets van de globale structuur bieden.
Soorten moleculaire geometrie
Zoals te zien is in het hoofdbeeld, hangt moleculaire geometrie af van hoeveel atomen het centrale atoom omringen. Als er echter een paar elektronen aanwezig zijn zonder te delen, zal het geometrie wijzigen omdat het veel volume inneemt. Daarom oefent het een sterisch effect uit.
Volgens dit kan geometrie een reeks karakteristieke vormen presenteren voor veel moleculen. En dit is waar de verschillende soorten moleculaire geometrie of moleculaire structuur ontstaan.
Wanneer is geometrie gelijk aan de structuur? Beide geven hetzelfde alleen aan in gevallen waarin de structuur niet meer dan één type geometrie heeft; Anders moeten alle aanwezige typen worden overwogen en de structuur een globale naam geven (lineair, vertakt, bolvormig, plat, enz.)).
Kan u van dienst zijn: HydraceGeometrieën zijn vooral nuttig om de structuur van een vaste stof uit zijn structurele eenheden te verklaren.
Lineair
Alle covalente bindingen zijn directioneel, dus de A-B-link is lineair. Maar zal de molecuul AB lineair zijn2? Zo ja, geometrie wordt eenvoudig weergegeven als: B-a-b. De twee B -atomen worden gescheiden door een hoek van 180º, en volgens de TEV moet een hybride sporterij orbitalen hebben.
Hoekig
 Bron: Gabriel Bolívar
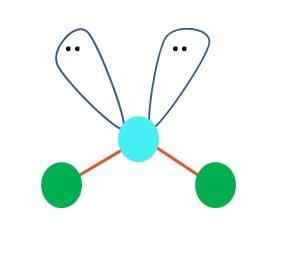
Bron: Gabriel Bolívar In eerste instantie kan een lineaire geometrie voor het AB -molecuul worden aangenomen2; Het is echter essentieel om de structuur van Lewis te trekken voordat hij tot een conclusie komt. Tekent de Lewis -structuur, u kunt het aantal ongewone elektronenparen identificeren (:) op het atoom van een.
Wanneer dit zo is, op de paren van elektronen de twee atomen van B naar beneden, veranderden hun hoeken. Als gevolg hiervan wordt het B-A-B-lineaire molecuul uiteindelijk een V, een boemerang of een hoekige geometrie (superieur beeld)
Het watermolecuul, H-O-H, is het ideale voorbeeld voor dit type geometrie. In het zuurstofatoom zijn er twee paren elektronen zonder te delen die onder een geschatte hoek van 109º zijn georiënteerd.
Waarom deze hoek? Omdat elektronische geometrie tetraëdrisch is, dat vier hoekpunten heeft: twee voor H -atomen en twee voor elektronen. Merk in het superieure beeld op dat de groene punten en de twee "lobben met ogen" een tetraëder tekenen met het blauwachtige punt in het midden.
Als de of geen vrije elektronen zou hebben, zou het water een lineair molecuul vormen, zou de polariteit afnemen en de oceanen, zeeën, meren, enz., Ze zouden waarschijnlijk niet bestaan omdat ze elkaar kennen.
Tetraëdrisch
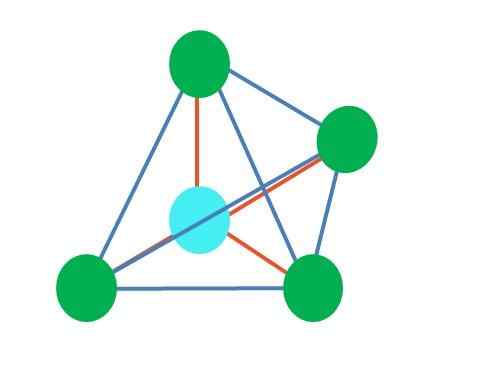 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Het bovenste beeld vertegenwoordigt tetraëdrische geometrie. Voor het watermolecuul is de elektronische geometrie tetraëdrisch, maar door elektronenvrije paren te elimineren kan worden opgemerkt dat het wordt omgezet in een hoekige geometrie. Dit wordt ook eenvoudig waargenomen door twee groene punten te elimineren; De resterende twee tekenen de V met het blauwe punt.
Wat als in plaats van twee paar vrije elektronen er maar één was? Dan zou er een trigonaal vlak zijn (hoofdafbeelding). Door een elektronische groep te elimineren, wordt het sterische effect dat door het paar vrije elektronen wordt geproduceerd echter niet vermeden. Daarom vervormt het het trigonale vlak tot een driehoekige basispiramide:
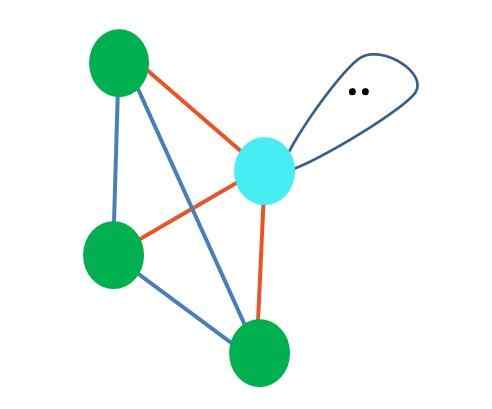 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Hoewel moleculaire geometrie -trigonale en tetraëdrische piramide verschillend zijn, is elektronische geometrie hetzelfde: tetraëdral. Dus de trigonale piramide telt niet als elektronische geometrie?
Het antwoord is nee, omdat het het product is van de vervorming veroorzaakt door de "lob met ogen" en het sterische effect, en de geometrie houdt geen rekening met latere vervormingen.
Om deze reden is het altijd belangrijk om de eerste elektronische geometrie te bepalen met behulp van Lewis -structuren voordat de moleculaire geometrie wordt gedefinieerd. Het ammoniakmolecuul, NH3, Het is een voorbeeld van moleculaire geometrie -trigonale piramide, maar met tetraëdrische elektronische geometrie.
Trigonale bipiramide
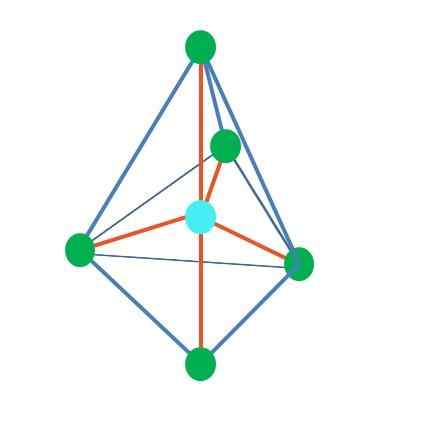 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Tot nu toe, met uitzondering van lineaire geometrie, in tetraëdrische, hoekige en trigonale piramide hebben hun centrale atomen sp hybridisatie SP3, Volgens de Tev. Dit betekent dat als de linkhoeken experimenteel werden bepaald, ze ongeveer 109º moeten zijn.
Het kan u van dienst zijn: Applied Chemistry: Object of Study, Takken, Bang, voorbeeldenUit de trigonale difarmidale geometrie zijn er vijf elektronische groepen rond het centrale atoom. In de bovenste afbeelding kun je zien met de vijf groene punten; Drie in de driehoekige basis, en twee in axiale posities, die de bovenste en onderste hoekpunten van de piramide zijn.
Welke hybridisatie heeft dan het blauwe punt? Het heeft vijf hybride orbitalen nodig om eenvoudige (oranje) bindingen te vormen. Dit bereikt het via de vijf orbitalen SP3D (product van het mengsel van een orbitale s, drie p en één d).
Bij het overwegen van vijf elektronische groepen is geometrie al blootgesteld, maar met elektronenparen zonder te delen, lijdt het opnieuw vervormingen die andere geometrieën genereren. Evenzo rijst de volgende vraag: deze paren kunnen elke positie van de piramide innemen? Dit zijn: de axiale of de equatoriale.
Axiale en equatoriale posities
De groene punten die de driehoekige basis vormen, bevinden zich in equatoriale posities, terwijl de twee aan de bovenste en onderste uiteinden, in axiale posities. Waar bij voorkeur het paar elektronen zal worden geplaatst zonder te delen? In die positie neemt dat af tot het maximale elektrostatische afstoting en sterisch effect.
In axiale positie zou het paar elektronen "druk" loodrecht (90º) op de driehoekige basis maken, terwijl als het in equatoriale positie zou zijn, de resterende elektronische groepen van de basis 120º worden gescheiden en de twee uiteinden op 90º (in plaats van op 90º (in plaats van drukken (in plaats van Drie, zoals bij de basis).
Daarom zal het centrale atoom proberen zijn elektronenvrije collega's in equatoriale posities te begeleiden om stabielere moleculaire geometrieën te genereren.
Oscillerend en vorm van t
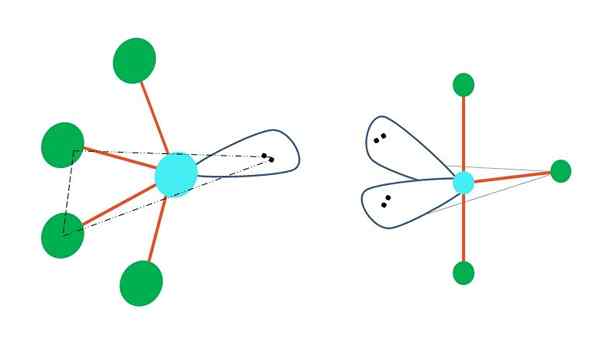 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Als een of meer van zijn atomen vrij van elektronen worden vervangen in trigonale bipirramide -geometrie, zouden verschillende moleculaire geometrieën ook hebben.
Links van het bovenste beeld verandert de geometrie in de oscillerende vorm. Daarin duwt het elektronenvrije koppel de rest van de vier atomen in de richting van dezelfde richting en buigt hun banden naar links. Merk op dat dit koppel en twee van de atomen in hetzelfde driehoekige vlak van het originele bipiramide liggen.
En rechts van de afbeelding, de geometrie in de vorm van t. Deze moleculaire geometrie is het resultaat van het vervangen van twee atomen door twee paar elektronen, wat resulteert dat de resterende drie atomen in hetzelfde vlak zijn uitgelijnd dat precies een letter t trekt.
Dus voor een molecuul van type AB5, Dit neemt trigonale bipyramide -geometrie aan. AB4, Met dezelfde elektronische geometrie zal het oscillerende geometrie overnemen; en AB3, T -vormige geometrie. In al ze zal (in het algemeen) spybridisatie hebben3D.
Om de moleculaire geometrie te bepalen, is het noodzakelijk om de Lewis -structuur en dus de elektronische geometrie te tekenen. Als dit trigonale bipiramide is, worden de elektronenvrije paren dan weggegooid, maar niet hun sterische effecten op de rest van de atomen. Het kan dus perfect worden onderscheiden tussen de drie mogelijke moleculaire geometrieën.
Octahedraal
Rechts van het hoofdbeeld wordt octaëdrische moleculaire geometrie weergegeven. Dit type geometrie komt overeen met AB -verbindingen6. Aab4 Ze vormen de vierkante basis, terwijl de resterende twee B zich in axiale posities positioneren. Aldus worden verschillende gelijkzijdige driehoeken gevormd, die de gezichten van de octaëder zijn.
Kan u van dienst zijn: activeringsenergieHier kunnen er nogmaals (zoals in alle elektronische geometrieën) vrije elektronenparen zijn en daarom uit dit feit andere moleculaire geometrieën ontlenen. Bijvoorbeeld AB5 Met octronistische elektronische geometrie bestaat het uit een piramide met vierkante basis, en AB4 van een vierkant vliegtuig:
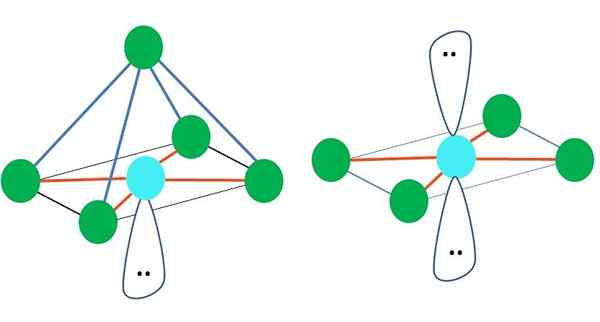 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar In het geval van octronistische elektronische geometrie zijn deze twee moleculaire geometrieën het meest stabiel in termen van elektrostatische afstoting. In de vierkante platte geometrie zijn de twee paren elektronen gescheiden 180º.
Wat is hybridisatie voor atoom in deze geometrieën (of structuren, als het de enige is)? Nogmaals, de TEV stelt vast dat het sp is3D2, Zes hybride orbitalen, waarmee u elektronische groepen in de hoekpunten van een octaëder kunt begeleiden.
Andere moleculaire geometrieën
Het wijzigen van de bases van de tot nu toe genoemde piramides, kunnen enkele meer complexe moleculaire geometrieën worden verkregen. De Pentagonal Bipiramid is bijvoorbeeld gebaseerd op een Pentagon en de verbindingen die formule hebben, hebben een algemene formule AB7.
Net als de andere moleculaire geometrieën, zal het vervangen van B -atomen door elektronenvrije paren geometrie vervormen tot andere vormen.
Ook verbindingen AB8 Ze kunnen geometrieën overnemen zoals vierkant antiprisme. Sommige geometrieën kunnen erg ingewikkeld worden, vooral voor AB -formules7 Van nu af aan12)).
Moleculaire geometrie -voorbeelden
Een reeks verbindingen wordt hieronder vermeld voor elk van de belangrijkste moleculaire geometrieën. Als oefening kunnen Lewis -structuren voor alle voorbeelden worden getekend en certificeren of, gezien elektronische geometrie, moleculaire geometrieën worden verkregen zoals deze hieronder worden vermeld.
Lineaire geometrie
-Ethyleen, h2C≡CH2
-Berylliumchloride, BECL2 (CL-be-Cl)
-Koolstofdioxide, CO2 (O = C = O)
-Stikstof, n2 (N≡N)
-Mercury Dibromure, hgbr2 (BR-HG-BR)
-Triyoduro Anion, ik3- (I-i-i)
-Madehydric Acid, HCN (H-N≡C)
De hoeken moeten 180º zijn en daarom SP -hybridisatie hebben.
Hoekige geometrie
-Water
-Zwaveldioxide, dus2
-Stikstofdioxide, nee2
-Ozon, of3
-Amiduro anion, NH2-
Trigonaal flat
-Bromine trifluoride, bf3
-Aluminium trichloride, alcl3
-Nitraatanion, nee3-
-Carbonaatanion, CO32-
Tetraëdrisch
-Gasmetano, ch4
-Koolstoftetrachloride, CCL4
-Ammoniumkation, NH4+
-Sulfaatanion, dus42-
Trigonale piramide
-Ammoniak, NH3
-Hydronio Cation, h3OF+
Trigonale bipiramide
-Phosporus Pentafluoruro, PF5
-Antimoon pentachloride, SBF5
Oscillerend
Zwavel tetrafluoride, SF4
Vorm van t
-Jodium trichloride, ICL3
-Chloor trifluoride, CLF3 (Beide verbindingen staan bekend als interhalogenen)
Octahedraal
-Hexafluoruro van zwavel, sf6
-Selenium hexafluoruro, sef6
-Hexaflorofosfaat, pf6-
Om te culmineren, is moleculaire geometrie degene die de waarnemingen van de chemische of fysische eigenschappen van de materie verklaart. Het is echter georiënteerd volgens elektronische geometrie, zodat deze laatste altijd moet worden bepaald vóór de eerste.
Referenties
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage Learning, p 194-198.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk., P. 23, 24, 80, 169). MC Graw Hill.
- Mark e. Tuckerman. (2011). Moleculaire geometrie en de VSEPR -theorie. Hersteld van: NYU.Edu
- Virtueel chemboek, Charles en. Ophardt. (2003). Inleiding tot moleculaire geometrie. Hersteld van: chemie.Elmhursst.Edu
- Chemistry Libhethexts. (8 september 2016). Geometrie van moleculen. Hersteld van: chem.Librhetxts.borg
- « Pedagogische onderwijsmodellen (traditioneel en actueel)
- De 25 meest populaire traditionele spellen »

