Ideaal gasmodel, gedrag, voorbeelden
- 5106
- 379
- Nathan Wiegand
A Ideaal gas of Perfect gas Het is er een waarin de kracht van aantrekkingskracht of moleculaire afstoting wordt beschouwd als onbeduidend tussen de deeltjes die het samenstellen, daarom is al zijn interne energie kinetisch, dat wil zeggen energie geassocieerd met de beweging.
In een dergelijk gas zijn de deeltjes meestal vrij ver van elkaar van elkaar, hoewel af en toe botsen met elkaar en met de wanden van de container.
 In het ideale gas zijn de deeltjes van elkaar weg
In het ideale gas zijn de deeltjes van elkaar weg Aan de andere kant doet in het ideale gas de grootte of massa van de deeltjes niet uit, omdat het volume dat ze bezet zijn, erg klein is in vergelijking met het volume van het gas zelf.
Dit is natuurlijk slechts een benadering, omdat er in werkelijkheid altijd enige mate van interactie is tussen atomen en moleculen. We weten ook dat de deeltjes ruimte innemen en massa hebben.
Deze veronderstellingen werken echter in veel gevallen vrij goed, zoals gassen met een laag molecuulgewicht, in een goed bereik van druk en temperaturen.
Gassen met een hoog molecuulgewicht, vooral bij hoge drukken of lage temperaturen, gedragen zich echter helemaal niet als ideale gassen en hebben andere modellen nodig die zijn gecreëerd met het doel ze met een grotere precisie te beschrijven.
[TOC]
Eerste experimenten
De wetten die gassen regelen zijn empirisch, dat wil zeggen dat ze voortkwamen uit experimenten. De meest opvallende experimenten werden uitgevoerd tijdens de zeventiende, achttiende en vroege negentiende eeuw.
Ten eerste zijn die van Robert Boyle (1627-1691) en Edme Mariotte (1620-1684), die onafhankelijk de druk in een gas en registreerde hun verandering van volume, ontdekken dat ze omgekeerd evenredig waren: bij grotere druk, minder volume.
 Robert Boyle
Robert Boyle Van zijn kant heeft Jacques Charles (1746-1823) dat volume vastgesteld en temperatuur Absoluut waren recht evenredig, zolang de druk constant bleef.
Het kan u van dienst zijn: stationaire golven: formules, kenmerken, typen, voorbeeldenAmadeo Avogadro (1776-1856) ontdekte dat twee identieke volumes verschillende gassen dezelfde hoeveelheid deeltjes bevatten, zolang de druk en temperatuur hetzelfde waren. En ten slotte zei Joseph de Gay Lussac (1778-1850), door het volume te houden, de druk in een gas recht evenredig is met de temperatuur.
De wetten van ideale gassen
Deze ontdekkingen worden uitgedrukt door eenvoudige formules, bellen P tot de druk, V Volume, N naar het aantal deeltjes en T De ideale gastemperatuur:
Law Boyle-Maleotte
Op voorwaarde dat de temperatuur is vastgesteld, treedt het volgende op:
P⋅v = constant
Charles Law
Wanneer het gas onder constante druk staat:
V / t = constant
Gay Lussac Law
Het gas op een vast volume houden is waar dat:
p / t = constant
Avogadro Law
Identieke gasvolumes hebben onder dezelfde druk- en temperatuuromstandigheden hetzelfde aantal deeltjes. Daarom kunnen we schrijven:
V ∝ n
Waarbij n het aantal deeltjes is en ∝ het symbool van evenredigheid is.
Ideaal gasmodel
Het ideale gasmodel beschrijft zodanig dat:
-Wanneer de deeltjes op elkaar inwerken, doen dit voor een zeer korte tijd, door elastische botsingen, waarin de impuls en kinetische energie worden bewaard.
-De samenstellende deeltjes zijn punctueel, met andere woorden, de diameter is veel lager dan de gemiddelde afstand die ze tussen een en andere botsing afleggen.
-Intermoleculaire krachten zijn niet -bestaand.
-Kinetische energie is evenredig met de temperatuur.
Monoatomische gassen - waarvan de atomen niet aan elkaar zijn gekoppeld - en een laag molecuulgewicht, in standaard omstandigheden van druk en temperatuur (atmosferische druk en 0 ° C temperatuur), ze hebben zo'n gedrag dat het ideale gasmodel een zeer goede beschrijving is voor hen.
Het kan u van dienst zijn: Vy Canis Majoris: Discovery, Kenmerken, Structuur, Training en EvolutieIdeale gasstatusvergelijking
De wetten van de bovenstaande gassen worden gecombineerd om de algemene vergelijking te vormen die het ideale gasgedrag regelt:
V ∝ n
V ∝ t
Daarom:
V ∝ n⋅t
Bovendien van de wet van Boyle:
V = constant / p
Dan kunnen we dat bevestigen:
V = (constante x n⋅t) / p
De constante wordt de gasconstante En het wordt aangeduid met letter r. Met deze keuze relateert de ideale gasvergelijking vier variabelen die de staat van gas beschrijven, namelijk N, R, P en T, vertrekken:
P⋅v = n⋅r⋅t
Deze relatief eenvoudige vergelijking is consistent met de wetten van ideale gassen. Als de temperatuur bijvoorbeeld constant is, wordt de vergelijking gereduceerd tot de Boyle-Maleotte-wet.
De gasconstante
Zoals we eerder hebben gezegd, in standaardtemperatuur- en drukomstandigheden, dat wil zeggen op 0ºC (273.15 k) en 1 drukatmosfeer, het gedrag van veel gassen ligt dicht bij het ideale gas. Onder deze omstandigheden is het volume van 1 mol gas 22.414 L.
In dat geval:
R = (p⋅v) / (n⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ K
Gasconstante kan ook worden uitgedrukt in andere eenheden, bijvoorbeeld in het internationale systeem als het de moeite waard is:
R = 8,314 J⋅ Mol-1⋅ K-1
Wanneer een probleem wordt opgelost door de ideale gassenwet, is het handig om aandacht te schenken aan de eenheden waarin de constante wordt uitgedrukt, want zoals we kunnen zien, zijn er veel mogelijkheden.
Gedrag van een ideaal gas
Zoals we hebben gezegd, gedraagt elk gas in standaard druk- en temperatuuromstandigheden dat een laag molecuulgewicht is, zich zeer dicht bij het ideale gas. Daarom is de vergelijking p⋅v = n⋅r⋅T van toepassing om de relatie te vinden tussen de vier variabelen die het beschrijven: n, p, v en t.
Het kan u van dienst zijn: Heisenberg Atomic ModelOp deze manier kunnen we ons een ideaal gasgedeelte voorstellen dat in een container is vergrendeld en gevormd door kleine deeltjes, die af en toe tegen elkaar botsen en met de wanden van de container, altijd elastisch.
Dit is wat we zien in de volgende animatie van een heliumgedeelte, een nobel en monoatomisch gas:
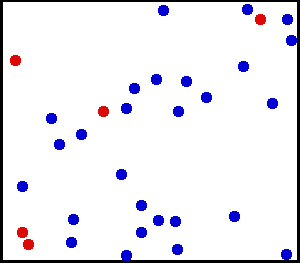 Het helium is een edelgas, in animatie wordt een deel van heliumatomen weergegeven in een container. De rode dienen om beweging beter te onderscheiden. Bron: Wikimedia Commons.
Het helium is een edelgas, in animatie wordt een deel van heliumatomen weergegeven in een container. De rode dienen om beweging beter te onderscheiden. Bron: Wikimedia Commons. Voorbeelden van ideale gassen
Een ideaal gas is een hypothetisch gas, dat wil zeggen, het is een idealisatie, maar in de praktijk gedragen veel gassen zich in een zeer op de buurt.
Edelgassen
Voorbeeld van gassen die zich als idealen gedragen onder standaardomstandigheden zijn edelgassen, evenals lichtgassen: waterstof, zuurstof en stikstof.
De aerostatische ballon
 Het ideale gasmodel legt uit hoe de heteluchtballon. Bron: Wikimedia Commons.
Het ideale gasmodel legt uit hoe de heteluchtballon. Bron: Wikimedia Commons. Op de aerostatische ballon van figuur 1 kan worden toegepast door de wet van Charles: het gas wordt verwarmd, daarom wordt de lucht die de wereld vult, en bijgevolg stijgt het op.
Heliumballonnen
Helium is, samen met waterstof, het meest voorkomende element in het universum, en toch is het schaars op aarde. Omdat een edelgas inert is, in tegenstelling tot waterstof, worden helium volledige ballonnen veel gebruikt als decoratieve elementen.
Referenties
- Atkins, P. 199999. Fysische chemie. Omega -edities.
- Chang, R. 2013. Scheikunde. 11VA. Editie. Mc Graw Hill Education.
- Cengel, en. 2012. Thermodynamica. 7e editie. McGraw Hill.
- Cimbala, c. 2006. Mechanica van vloeistoffen, basisprincipes en toepassingen. MC. Graw Hill.
- Giambattista, een. 2010. Natuurkunde. 2e. ED. McGraw Hill.
- « Natuurlijke omgevingskenmerken, elementen, belang, voorbeelden
- Voorbeelden van appellatieve functie en kenmerken »

